
下面有关晶体的叙述中,不正确的是( )
| A.金刚石为空间网状结构,由共价键形成的碳原子环上,最小的环上有6个碳原子 |
| B.氯化钠晶体中,每个Na+周围距离相等的Na+共有6个 |
| C.氯化铯晶体中,每个Cs+周围紧邻8个Cl- |
| D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子 |
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:填空题
(5分)用相关的化学用语表示下列物质:
⑴ 写出电子式Al3+ Cl
⑵ 写出下列物质的结构式:N2 CO2
⑶ 用电子式表示NaOH_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
卤族元素的单质和化合物很多。
(1)卤素原子与氢原子形成的共价键中,极性最强键的是_____。NaF、MgF2、SiF4三种晶体的熔点从高到低的顺序是______。
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列_____式发生。
A.CsICl2=CsCl+ICl B.CsICl2=CsI+Cl2
(3)CH3Cl、BF3、SCl2三种分子中属于极性分子的是 ,ClO2-中心氯原子的杂化轨道类型为______,写出一种与SO32-互为等电子体的分子 。
(4)已知CaF2晶体(见图)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻最近的 两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域。回答下列问题:
(1)铜原子基态电子排布式为 ;
(2)用晶体的x射线衍射法可以测得阿伏加德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361 pm。又知铜的密度为9.00g·cm-3,则铜晶胞的体积是
cm3、晶胞的质量是 g,阿伏加德罗常数为 (列式计算,己知Ar(Cu)=63.6);
(3)氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如下图),a位置上Cl原子的杂化轨道类型为 。已知其中一种化合物的化学式为KCuCl3,另一种的化学式为 ;
(4)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是 ,反应的化学方应程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
高温下超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。下图所示为超氧化钾晶体的一个晶胞,则下列说法中正确的是
| A.晶体中,0价氧与-2价氧的数目比为2:1 |
| B.晶体中每个K+周围有8个O2-,每个O2-周围有8个K+ |
| C.晶体中与每个K+距离最近的K+有8个 |
| D.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某研究所合成了一种球形分子,它的分子式为C60Si60,其结构中包含有C60和Si60结构。下列对该分子的叙述中正确的是
| A.分子中Si60被包裹在C60里面 | B.形成的晶体属于分子晶体 |
| C.其摩尔质量为2400 | D.熔点高、硬度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cl- 离子核间距为a cm,氯化铯的摩尔质量为M g/mol,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )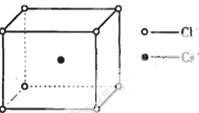
A. | B.   | C. | D. |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法不正确的是
| A.氯化钠晶体中,每个Cl-周围最近且距离相等的Cl-共有12个 |
| B.分子晶体中有范德华力,也有共价键 |
| C.干冰晶体中,每个CO2分子周围最近且距离相等的CO2分子共有12个 |
| D.晶体熔点:晶体硅<SiC |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
物质的非晶体能自动转变为晶体,而晶体却不能自动地转变为非晶体,这说明( )。
| A.非晶体是不稳定的,处于晶体时能量小 |
| B.晶体是稳定的,处于晶体时能量大 |
| C.非晶体是不稳定的,处于晶体时能量小 |
| D.晶体是不稳定的,处于晶体时能量小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com