
分析 (1)加少量FeSO4作催化剂,即发生反应,结合第2步反应可知,第1步中亚铁离子被氧化;
(2)由两步反应遵循电子守恒的前提下相加得到总反应;
(3)Cu与浓硫酸加热反应可制备硫酸铜;
(4)结合酸的用量及对环境的污染分析.
解答 解:(1)加少量FeSO4作催化剂,即发生反应,结合第2步反应可知,第1步中亚铁离子被氧化,发生的离子反应为4Fe2++O2+4H+=4Fe3++2H2O,
故答案为:4Fe2++O2+4H+=4Fe3++2H2O;
(2)由①4Fe2++O2+4H+=4Fe3++2H2O、②2Fe3++Cu═2Fe2++Cu2+可知,①+②×2可知总反应为2Cu+O2+2H2SO4=2 CuSO4+2H2O,
故答案为:2Cu+O2+2H2SO4=2 CuSO4+2H2O;
(3)用Cu制备CuSO4的另一种方法可用化学方程式表示为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(4)方法2中生成有毒气体,且消耗酸多,而方法1中硫酸用量少,不生成有毒气体污染环境,则制备方法前者好,
故答案为:前;减少硫酸用量;不会产生对大气污染的SO2.
点评 本题考查硫酸铜的制备实验及评价,为高频考点,把握物质的性质及发生的反应、实验评价为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
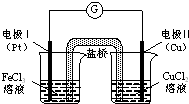
| A. | 电极Ⅰ上发生还原反应,作原电池的正极 | |
| B. | 电极Ⅱ的电极反应式为:Cu-2e-═Cu2+ | |
| C. | 该原电池的总反应为:2Fe3++Cu═Cu2++2Fe2+ | |
| D. | 盐桥中装有含氯化钾的琼脂,其作用是传递电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
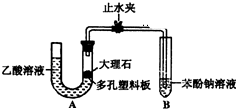 某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.探究乙酸、碳酸和苯酚的酸性强弱关系该校学生设计了如图的实验装置(夹持仪器已略去).
某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.探究乙酸、碳酸和苯酚的酸性强弱关系该校学生设计了如图的实验装置(夹持仪器已略去). -ONa溶液的pH,其pH由大到小排列的顺序为bdac (填溶液编号)
-ONa溶液的pH,其pH由大到小排列的顺序为bdac (填溶液编号)查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | _氯气与水反应生成的HClO将石蕊氧化为无色物质 |
| 然后溶液从无色逐渐变为浅黄绿色 | 继续通入的氯气溶于水使溶液呈浅黄绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
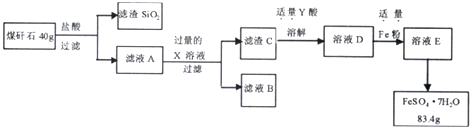
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com