
【题目】已知A可以作水果的催熟剂,D是食醋的主要成分。相关的转化关系如下:请回答下列问题:
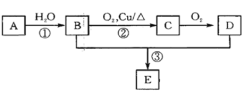
⑴A的结构简式为__________,反应①的反应类型是_______。
⑵B的同分异构体的结构简式为______;C的官能团名称是_______。
⑶反应③的化学方程式为_______________,该反应类型是__________________。
【答案】CH2=CH2 加成反应 CH3OCH3 醛基 CH3COOH+CH3CH2OH ![]() CH3COOC2H5+H2O 取代反应
CH3COOC2H5+H2O 取代反应
【解析】
由A可以作水果的催熟剂,D是食醋的主要成分可知,A是CH2=CH2,D是CH3COOH,由有机物转化关系可知,CH2=CH2和水发生加成反应生成CH3CH2OH,则B为CH3CH2OH,CH3CH2OH发生催化氧化生成,则C为CH3CHO;CH3CHO被氧化生成乙酸D,B和D发生酯化反应生成CH3COOCH2CH3,则E为CH3COOCH2CH3。
(1)通过以上分析知,A为CH2=CH2,反应①的反应类型是加成反应,故答案为:CH2=CH2;加成反应;
⑵B为乙醇,结构简式为CH3CH2OH,甲醚与乙醇互为同分异构体,结构简式为CH3OCH3;C的结构简式为CH3CHO,官能团为醛基,故答案为:CH3OCH3;醛基;
(3)反应③为在浓硫酸作用下,乙醇与乙酸共热发生酯化反应生成乙酸乙酯,反应的化学方程式为CH3COOH+CH3CH2OH ![]() CH3COOC2H5+H2O,酯化反应属于取代反应,故答案为:CH3COOH+CH3CH2OH
CH3COOC2H5+H2O,酯化反应属于取代反应,故答案为:CH3COOH+CH3CH2OH ![]() CH3COOC2H5+H2O;取代反应。
CH3COOC2H5+H2O;取代反应。


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.金刚石晶体中的最小碳原子环由6个碳原子构成
B.金刚石晶体中的碳原子是sp2杂化的
C.12g金刚石中含有C-C键的个数为4NA
D.金刚石化学性质稳定,即使在高温下也不会和O2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中的实线表示元素周期表的边界。①~⑧分别表示元素周期表中对应位置的元素。
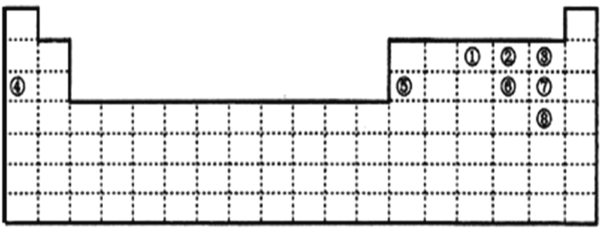
(1)上述元素所能形成的简单离子中半径最小的是________(填离子符号),最高价氧化物对应水化物酸性最强的是________(填分子式)。
(2)写出④与⑥形成的化合物的形成过程____________________
(3)元素①的氢化物电子式为______________。
(4)④、⑤、⑥各自的最高价氧化物对应的水化物两两皆能反应,它们反应的离子方程式为____________,______________,_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是
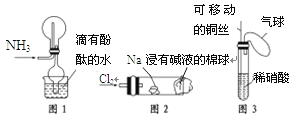
①实验室收集氨气采用图1所示装置
②实验室做氯气与钠的反应实验时采用图2所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图3所示装置进行铜与稀硝酸的反应
A. ②③④B. ①②③C. ①②④D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾可以通过电解法进行制备,装置如图所示,下列说法错误的是
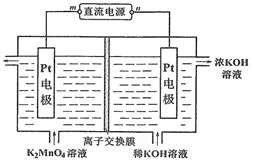
A. 阳极的电极反应式:MnO42- – e-= MnO4-
B. 该装置的离子交换膜为阳离子交换膜
C. 当电路通过a mol电子时,阴极室电解质溶液增加2a mol离子
D. 若电解流出液中KMnO4、K2MnO4和KOH物质的量之比为a∶b∶c,则流进电解池的电解液中K2MnO4和KOH的物质的量之比为 (a + b)∶( c + a )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | ④ | ||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
⑴①元素的名称:_______,⑧元素的符号:_______;
⑵在这些元素中,最活泼的金属元素的离子结构示意图是____,最活泼的非金属元素是____(填元素符号,下同),____是最不活泼的元素;
⑶这些元素的最高价氧化物对应水化物中,______(填化学式,下同)酸性最强,________碱性最强;能形成两性氢氧化物的元素是____(填元素符号);
⑷在⑤到的元素中,_______(填元素符号)原子半径最小;
⑸⑤和⑦两种元素最高价氧化物对应的水化物相互反应的离子方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学能可与热能、电能等相互转化。下列说法正确的是( )

A.图Ⅰ所示的装置能将化学能转化为电能
B.中和反应中,反应物的总能量比生成物的总能量低
C.化学反应中能量变化的主要原因是化学键的断裂与形成
D.图Ⅱ所示的反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
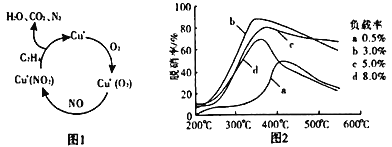
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。回答下列问题:
(1)已知2NO2(g)=N2O4(g) △H=-55.3kJ/mol;N2O5(g)=2NO2 (g)+![]() O2(g) △H=+53.1 kJ/mol;写出N2O5分解生成N2O4与O2的热化学方程式________________
O2(g) △H=+53.1 kJ/mol;写出N2O5分解生成N2O4与O2的热化学方程式________________
(2)一定温度下2N2O5(g)=4NO2(g)+O2(g),在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是______(填字母序号)。
a.NO2和O2的浓度比保持不变 b.容器中压强不再变化
c.2v正(NO2)=v逆(N2O5) d.气体密度不变
(3)以乙烯(C2H4)作为还原剂脱硝(NO),脱硝机理如图1。若反应中n(NO)︰n(O2)=2︰1,则总反应的化学方程式为_____;脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2,为达到最佳脱硝效果,应采用的条件是负载率____温度____。
(4)T温度时在容积为2L的恒容密闭容器中发生反应:2NO(g)+O2(g)![]() 2NO2(g) △H<0。实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
2NO2(g) △H<0。实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
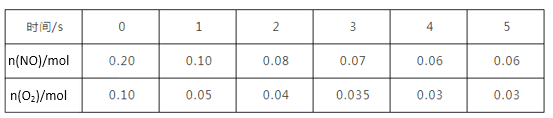
①从0~2s内该反应的平均速率v(NO)=________。
②T1温度时化学平衡常数K=_________ (结果保留3位有效数字)。
③若将容器的温度改变为T2时其k正=k逆,则T2_______T1(填“>”、“<”或“=")
④已知2NO(g)+O2(g)![]() 2NO2的反应历程为:
2NO2的反应历程为:
第一步NO+NO![]() N2O2 快速平衡 第二步N2O2+O2→2NO2 慢反应
N2O2 快速平衡 第二步N2O2+O2→2NO2 慢反应
下列叙述正确的是________(填标号)。
A.v(第一步的正反应)<v(第二步的反应) B.总反应快慢由第二步决定
C.第二步的活化能比第一步的高 D.第二步中N2O2与O2的碰撞100%有效
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)乙醇是一种重要的化工原料,也常用于生产乙醇汽油,解决燃油替代问题。最新以生物质为原料合成乙醇的方案设计中,化学家提出了用H2还原乙酸的方法来提高乙醇的产率和品质。
(1)用H2还原乙酸获得乙醇的反应为 CH3COOH(g)+2H2(g)![]() CH3CH2OH(g)+H2O(g) ΔH。该反应在一定条件下能自发进行,则ΔH__________(填“<”或“>”)0。
CH3CH2OH(g)+H2O(g) ΔH。该反应在一定条件下能自发进行,则ΔH__________(填“<”或“>”)0。
(2)已知该工艺中存在副反应:CH3COOH(g)+H2(g)![]() CO(g)+CH4(g)+H2O(g) ΔH>0。下列措施不能提高乙醇产率的是_____________。
CO(g)+CH4(g)+H2O(g) ΔH>0。下列措施不能提高乙醇产率的是_____________。
A.升高温度 B.增大压强
C.选择合适催化剂 D.增大![]()
(3)下列描述能说明反应CH3COOH(g)+2H2(g)![]() CH3CH2OH(g)+H2O(g)已达化学平衡的是________。
CH3CH2OH(g)+H2O(g)已达化学平衡的是________。
A.氢气、乙酸、乙醇的浓度相同 B.2v(H2)正=v(CH3CH2OH)逆
C.生成1 mol CH3COOH的同时生成1 mol H2O D.体系中乙醇的百分含量保持不变
(4)在![]() =2的条件下投料,某研究小组进行了在相同压强下在相同时间内乙醇的产率随温度变化的测定实验。在图中画出乙醇的产率随温度变化的示意图__________。
=2的条件下投料,某研究小组进行了在相同压强下在相同时间内乙醇的产率随温度变化的测定实验。在图中画出乙醇的产率随温度变化的示意图__________。

(二)NO2是大气污染的主要污染物之一;硝酸盐是水体污染的污染物之一。电化学降解NO3-的原理如图所示,阴极电极反应式为___________________________。
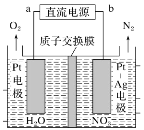
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com