
【题目】(1)已知室温下BaSO4的Ksp =1.1×1010,欲使溶液中c(SO42-)≤1.0×106 mol·L1,应保持溶液中c(Ba2+)≥___________。
(2)向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色,反应的离子方程式为_______________
(3)25℃时,有c(CH3COOH)+c(CH3COO-)= 0.1mol·L1的醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示。

下列有关溶液中离子浓度关系的叙述正确的是_____________。(错选不得分)
A.pH=5.5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B.W 点所表示的溶液中:c(Na+)+c(H+)= c(CH3COOH)+c(OH-)
C.pH = 3.5的溶液中:c(Na+) +c(H+) c(OH-) +c(CH3COOH)= 0.1mol·L1
D.向W点所表示的1.0 L 溶液中通入0.05 mol HCl 气体(溶液体积变化可忽略):c(H+)= c(CH3COOH)+c(OH-)
【答案】1.1×104 mol·L1 2AgC1+S2 =Ag2S +2C1 BC
【解析】
根据溶度积计算溶液中离子浓度大小;根据沉淀转化规律书写离子方程式;根据图像中离子浓度变化及弱电解质的电离平衡分析溶液中离子浓度大小。
(1)Ksp =c(SO42-)c(Ba2+)=1.0×106 mol·L1×c(Ba2+)=1.1×1010,则c(Ba2+)=1.1×1010/1.0×106= 1.1×104 mol·L1,故答案为 1.1×104 mol·L1;
(2)黑色的Ag2S比AgCl更难溶,则反应的离子方程式为2AgC1+S2 =Ag2S +2C1;
(3)根据图象知,随着溶液pH增大,则溶液中醋酸浓度降低、醋酸根离子浓度增大,则实线是醋酸根离子浓度、虚线是醋酸浓度变化,
A. 当pH=5.5时,根据图象知c(CH3COOH)<c(CH3COO),故A错误;
B.W点所表示的溶液中c(CH3COOH)=c(CH3COO),溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(CH3COO)+c(OH),所以得c(Na+)+c(H+)=c(CH3COOH)+c(OH),故B正确;
C.pH=3.5的溶液中存在物料守恒,根据物料守恒、电荷守恒得c(CH3COOH)+c(CH3COO)=c(Na+)+c(H+)c(OH)+c(CH3COOH)=0.1molL1,故C正确;
D. 向W点所表示溶液中通入0.05molHCl气体,原有平衡被打破,建立起了新的平衡,溶液中电荷守恒关系为:c(Na+)+c(H+)=c(CH3COO)+c(OH)+c(Cl);物料守恒关系为:2c(Cl)=c(CH3COO)+c(CH3COOH)=0.1molL1,得2c(Na+)+2c(H+)=3c(CH3COO)+2c(OH)+c(CH3COOH),c(Na+)=0.05mol/L,c(CH3COOH)+c(CH3COO)=0.1mol/L,所以得c(H+)═c(CH3COO)+c(OH),故D错误。
故答案为BC。


科目:高中化学 来源: 题型:
【题目】对下列实验现象及其解释不正确的是( )
A.金属钠在Cl2中燃烧产生白烟,这是因为产生的NaCl固体颗粒分散到空气中所致
B.把烧红的铁丝放在氧气中,发出耀眼白光,产生黑色固体,这是因为该反应放热多,生成的Fe3O4为黑色
C.单质Mg、Al与O2反应,条件不同,可能产生不同的产物
D.镁带在空气中点燃发出耀眼光芒,常用于制照明弹,主要发生反应:2Mg+O2![]() 2MgO,其中,Mg作还原剂
2MgO,其中,Mg作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化剂与还原剂的判断正确的是( )
A. 反应CH4+2O2![]() CO2+2H2O中,O2是氧化剂,CH4是还原剂
CO2+2H2O中,O2是氧化剂,CH4是还原剂
B. 反应Cl2+2NaOH===NaClO+NaCl+H2O中,Cl2是氧化剂,NaOH是还原剂
C. 反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O中,HCl是氧化剂,MnO2是还原剂
MnCl2+Cl2↑+2H2O中,HCl是氧化剂,MnO2是还原剂
D. 反应2Na+2H2O===2NaOH+H2↑中,H2O既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下平衡:2SO2(g)+O2(g)2SO3(g) △H= QkJ/mol(Q>0),某研究小组研究了其他条件不变时,改变某一条件对上述平衡的影响,下列分析正确的是

A. 图I研究的是t0时刻增大O2的浓度对平衡的影响
B. 图II研究的是t0时刻加入催化剂后对反应速率和平衡的影响
C. 图III研究的是催化剂对平衡的影响,且甲的催化效率比乙高
D. 图III研究的是温度对化学平衡的影响,且乙的温度较低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列仪器:

(1)海水蒸馏是由海水获得淡水的常用方法之一,在实验室里组成一套蒸馏装置肯定 需要上述仪器中的一部分,按照实验仪器从下到上、从左到右的顺序,依次是__________ (填序号);仪器⑤的冷凝水应从________(填“a”或“b”)口进入。
(2)海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要上述仪器 中的______(填序号),该仪器名称为__________,向该碘水中加入四氯化碳以提取碘 单质的实验操作叫做_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。 合成塔中发生反应为: N2(g)+3H2(g)![]() 2NH3(g) △H<0
2NH3(g) △H<0
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H>0
CO2(g)+H2(g) △H>0
①t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。
该温度下此反应的平衡常数K =__________________________。
②保持温度不变,向上述平衡体系中再加入0.1mol CO,当反应重新建立平衡时,水蒸气的总转化率α (H2O)__________。
(2)下表为不同温度下合成氨反应的平衡常数。由表可推知T1_____573K(填“>”、“<”或“=”)。
T/K | T1 | 573 | T2 |
K | 1.00×107 | 2.45×105 | 1.88×103 |
(3)673K,30MPa下n(NH3) 和n(H2) 随时间变化的关系如下图所示依据上图,下列有关叙述正确的是(填写序号)_________________。

A.c点表示n(NH3)和n (H2)相等
B.c点表示NH3生成速率与NH3分解速率相同
C.e点和d点时反应的平衡常数相同
D.c点时正反应速率大于逆反应速率
(4)用NO2溶于水制硝酸:3NO2+H2O![]() 2HNO3+NO。从生产流程看,吸收塔中需
2HNO3+NO。从生产流程看,吸收塔中需
要补充空气,其原因用化学平衡移动的理论进行解释是______________。
(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索
利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表中短周期的一部分。已知A元素原子的最外层电子数比其电子层数的3倍还多。下列关于表中六种元素的说法正确的是 ( )
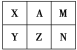
A. X的单质在空气中可以燃烧
B. X、Y、Z三种元素中Y元素形成的单核阴离子半径最大
C. 最高价氧化物对应的水化物酸性最强的是A元素
D. A单质通入NaZ溶液中,根据反应现象可证明A、Z非金属性的相对强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室中浓硫酸试剂瓶标签上的部分内容,请回答问题。
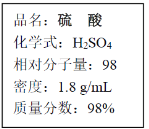
(1)该硫酸的物质的量浓度是________mol/L。
(2)某实验需要90mL3.0mol/L稀硫酸,配制该溶液,经计算,需要用量筒量取___mL浓硫酸。
(3)在下列配制过程示意图中,有错误的是(填写序号)________。

(4)下列情况会引起所配稀硫酸浓度偏高的是________。
A 用蒸馏水将量筒中残留的硫酸洗出合并 B 容量瓶洗涤后,未经干燥处理
C 溶液未能冷却就定容 D 未洗涤烧杯和玻璃棒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求填空:
(1)写出有机物![]() 的名称________。
的名称________。
(2)当乙酸分子中的O都是18O时,乙醇分子中的O都是16O时,二者在一定条件下反应,生成物中水的相对分子质量为______。
(3)化学与生活息息相关。下列叙述正确的是___(填字母代号)。
A.馒头越嚼越甜 B.鲜榨橙汁遇到碘水会变蓝
C.油脂经水解可变成葡糖糖 D.土豆中的淀粉经水解可变成酒
(4)某化合物C3H6O2的核磁共振谱(NMR)中有3个峰,其强度比为3∶2∶1,则该化合物的结构简式可能为_______(写出一种即可)。
(5)瑞香素是一种具有抗菌、抗炎、抗凝血等生物活性的香豆素化合物,其分子结构如图所示。回答下列问题。
![]()
①瑞香素的化学式为____,含氧官能团名称____;
②1mol此化合物可与______molBr2反应,最多可以与____molNaOH反应。
(6)甲醛和新制氢氧化铜的反应显示了甲醛的还原性,发生反应的化学方程式通常表示为HCHO+2Cu(OH)2+NaOH![]() HCOONa+Cu2O↓+3H2O。若向足量新制氢氧化铜中加入4.00mL甲醛水溶液,充分反应。请设计一个简单实验验证甲醛的氧化产物不是甲酸盐。____。(可供选用的试剂:硫酸铜溶液、甲醛、甲酸、氢氧化钠溶液。)
HCOONa+Cu2O↓+3H2O。若向足量新制氢氧化铜中加入4.00mL甲醛水溶液,充分反应。请设计一个简单实验验证甲醛的氧化产物不是甲酸盐。____。(可供选用的试剂:硫酸铜溶液、甲醛、甲酸、氢氧化钠溶液。)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com