
 ;DB2有多种重要的用途,请你写出其中的一种:制玻璃、制光导纤维、制粗硅(其中一种).
;DB2有多种重要的用途,请你写出其中的一种:制玻璃、制光导纤维、制粗硅(其中一种).分析 根据A元素的气态氢化物是一种广泛应用的优质气体燃料,可推知A是C,B元素可与A组成CB2型化合物,且O元素的氢化物水是用途最为广泛的溶剂,可推知B是O,DO2中,D与O的质量比为7:8,所以D是Si,在EB2中,E与B的质量比为1:1,所以E是S,O元素可与C组成CO2型化合物,且A、B、X位于同一周期,即X为N,
(1)根据氮气的结构、二氧化硅的用途答题;
(2)氨气分子间有氢键,易液化;
(3)结合氮化硅陶瓷的性质来回答;
(4)二氧化硫与氯水发生氧化还原反应,生成硫酸根离子和氯离子;
(5)碳酸根、亚硫酸根能和强酸反应产生气体,亚硫酸根、硫酸根能和BaCl2溶液反应生成白色沉淀,且均不溶于硝酸中
解答 解:根据A元素的气态氢化物是一种广泛应用的优质气体燃料,可推知A是C,B元素可与A组成CB2型化合物,且O元素的氢化物水是用途最为广泛的溶剂,可推知B是O,DO2中,D与O的质量比为7:8,所以D是Si,在EB2中,E与B的质量比为1:1,所以E是S,O元素可与C组成CO2型化合物,且A、B、X位于同一周期,即X为N,
(1)X单质分子为氮气,是含有氮氮三键的物质,它的电子式为: ,二氧化硅可以制玻璃、制光导纤维、制粗硅等,
,二氧化硅可以制玻璃、制光导纤维、制粗硅等,
故答案为: ;制玻璃、制光导纤维、制粗硅(其中一种);
;制玻璃、制光导纤维、制粗硅(其中一种);
(2)氨气分子易液化,因为分子之间存在有氢键,使其沸点较高,
故答案为:氨气分子之间存在有氢键,使其沸点较高;
(3)氮化硅是一种硬度很高的物质,具有抗腐蚀的性质,不具有润滑性和强还原性耐磨损,
故答案为:①②④;
(4)E是S,E元素的一种氧化物可与过氧化钠及氯水发生氧化还原反应,该氧化物为二氧化硫,二氧化硫与氯水反应的离子方程式为SO2+Cl2+2H2O═4H++2Cl-+SO42-,
故答案为:SO2+Cl2+2H2O═4H++2Cl-+SO42-;
(5)CO32-,SO32-能和盐酸反应产生无色气体,再加足量的BaCl2溶液,有白色沉淀产生,再加入足量稀硝酸,白色沉淀质量减少,说明沉淀中一定有碳酸钡也一定有硫酸钡,碳酸根一定存在,但是硫酸钡中的硫酸根是硫酸根本身存在还是硝酸将亚硫酸根氧化来的不能确定,所以一定有CO32-,SO32-和SO42-至少有一种,一定没有S2O32-,
故答案为:一定有CO32-,一定没有S2O32-,SO32-和SO42-至少有一种.
点评 本题是一道关于元素周期表结构以及元素周期律知识的综合题,考查角度广,难度较大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
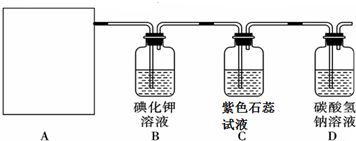
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S2-和HS- | B. | H3O+和OH- | C. | Na+和NH${\;}_{4}^{+}$ | D. | K+和Ne |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
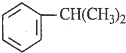 ),是一种重要的有机化工原料.根据题意完成下列填空:
),是一种重要的有机化工原料.根据题意完成下列填空: $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$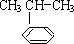 ,反应类型为加成反应
,反应类型为加成反应查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 利尿酸分子中有三种含氧官能团,在核磁共振氢谱上共有六个峰 | |
| B. | 1 mol兴奋剂X与足量浓溴水反应,最多消耗4 mol Br2 | |
| C. | 两种兴奋剂最多都能和含3molNaOH的溶液反应 | |
| D. | 两种分子中的所有碳原子均不可能共平面 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com