
| A. | 纯净物 | B. | 化合物 | C. | 电解质 | D. | 强电解质 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 明矾与水反应成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 溶液中溶质粒子能通过滤纸,胶体中分散质粒子不能通过滤纸 | |
| C. | 水泥厂、冶金厂用高压电作用于气溶胶以除去烟尘,是利用了电泳原理 | |
| D. | 江河入海口三角洲的形成通常与胶体的性质有关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能电离出H+的化合物叫做酸 | |
| B. | 含有金属元素的离子一定都是阳离子 | |
| C. | 金属氧化物不一定能与酸反应生成盐和水 | |
| D. | 由同种元素组成的物质肯定是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 麦芽糖和稀硫酸共热 | |
| B. | 蛋白质溶液中加入饱和NaCl溶液,有沉淀析出 | |
| C. | 蛋白质溶液中加入浓NaOH溶液 | |
| D. | 氨基酸中加入盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开发太阳能、水能、风能、可燃冰等新能源,减少使用煤、石油等化石燃料 | |
| B. | 将煤进行气化处理,提高煤的综合利用效率 | |
| C. | 研究采煤、采油新技术,提高产量以满足工业生产的快速发展 | |
| D. | 实现资源的“3R”利用观,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、资源的循环再生(Recycle) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当SO3的生成速率与SO2的消耗速率相等时反应达到平衡 | |
| B. | 达到平衡时,O2的转化率是31.5% | |
| C. | 达到平衡时,SO2的转化率是31.5% | |
| D. | 降低温度,正反应速率减小程度比逆反应速率减小程度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
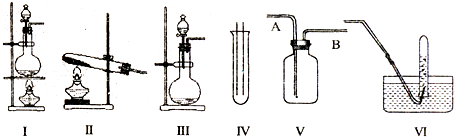
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

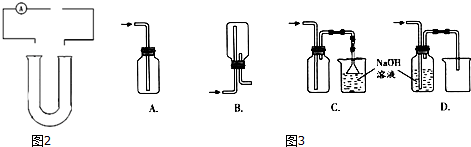
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com