
 ②
②
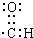 ③
③
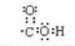 ④-C≡C-
④-C≡C- .
. 分析 ①羟基中氧原子与氢原子共用1对电子,氧原子核外有7个电子;
②为醛基,碳原子与氧原子共用2对电子,与氢原子共用1对电子,碳原子周围有7个电子;
③为羧基,羟基由一个氧原子和一个氢原子构成,氧原子最外层6个电子,氢原子最外层一个电子,二者形成一个共用电子对;
④为碳碳三键,两个碳原子共用三对电子,每个碳原子各有1个单电子.
解答 解:①羟基中存在一个碳氧共用电子对,羟基的电子式为: ,故答案为:
,故答案为: ;
;
②醛基中碳原子含有一个孤电子,碳原子和氧原子形成两对共用电子对、和氢原子形成一对共用电子对,所以其电子式为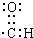 ,故答案为:
,故答案为: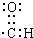 ;
;
③碳原子最外层有4个电子,与1个氧原子共用2对电子形成1个C=O,与1个羟基氧原子共用1对电子形成1个C-O键,羟基中氧原子与氢原子共用1对电子,电子式为: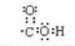 ,故答案为:
,故答案为: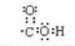 ;
;
④碳碳三键中两个碳原子共用三对电子,每个碳原子各有1个单电子,电子式为: ,故答案为:
,故答案为: .
.
点评 本题考查了电子式的书写,明确电子式书写的原则和方法是解题关键,注意没成键的电子也必须表示出来.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们的最高价氧化物的相应水化物的碱性依次减弱,酸性依次增强 | |
| B. | 它们的原子半径依次增大 | |
| C. | 它们的单质在常温.常压下的密度依次减小 | |
| D. | 它们的最高价氧化物的水化物都是强电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
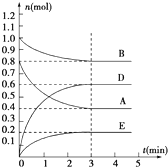 在容积为2L的密闭容器内,T℃时发生反应:mA(g)+nB(g)?pD(g)+qE(s)△H<0(m、n、p、q为最简比例的整数)反应过程如图所示:
在容积为2L的密闭容器内,T℃时发生反应:mA(g)+nB(g)?pD(g)+qE(s)△H<0(m、n、p、q为最简比例的整数)反应过程如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)随温度的升高而降低 | |
| B. | 35℃时,c(H+)>c(OH-) | |
| C. | 溶液pH:pH(35℃)>pH(25℃) | |
| D. | 35℃时已电离的水的浓度约为1.45×10-7 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C的质量分数降低 | B. | 平衡向右移动 | C. | B的转化率升高 | D. | x+y<z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com