
【题目】反应NH4Cl+NaNO2═NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油的开采。下列表示反应中相关微粒的化学用语正确的是( )
A.中子数为18的氯原子:![]() Cl
Cl
B.H2O的电子式:![]()
C.Na+的结构示意图:![]()
D.N2的结构式:N═N
【答案】B
【解析】
此题考查化学用语,化学用语包括:化学式,结构式,电子式,原子(或离子)结构示意图以及不同核素的表达等,根据各化学用语的书写要点分析。
A.核素的表达式![]() 中A表示X原子的质量数,Z表示X原子的质子数,则中子数=A-Z,中子数为18的氯原子为
中A表示X原子的质量数,Z表示X原子的质子数,则中子数=A-Z,中子数为18的氯原子为![]() Cl,A错误;
Cl,A错误;
B.氧原子最外层有6个电子,两个氢原子分别和氧原子形成1对共用电子对, B正确;
C.钠原子的核外有11个电子,钠离子是由钠原子失去一个电子形成的,则钠离子核外有10个电子,Na+的结构示意图为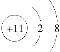 ,C错误;
,C错误;
D.氮原子最外层电子数为5,还需要3个电子(或形成3对共用电子对)达到8电子稳定结构,所以两个氮原子共用3对电子,氮气的结构式为N≡N,D错误。
答案选 B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】人类利用能源经历了三个时期。
(1)柴草时期:从能量转化的角度看,木材燃烧时化学能主要转化成__能和光能。
(2)化石能源时期:天然气的主要成分是甲烷。甲烷的电子式为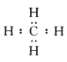 ,其化学键类型是__(选填“离子键”或“共价键”)
,其化学键类型是__(选填“离子键”或“共价键”)
(3)石油化工生产可以合成某有机物,其分子球棍模型如图所示。
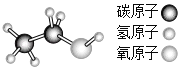
据此写出该物质的结构式或结构简式__。
(4)多能源结构时期:基于环保理念,将逐步减少传统燃油汽车的使用,燃料电池汽车将有更广阔的发展前景。下图为氢氧燃料电池的示意图,其基本工作原理与铜锌原电池相同。

根据图中电子流动方向判断A电极是__(选填“正极”或“负极”);氢氧燃料电池的优点是__(写一条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡可用作媒染剂,有机合成中氯化的催化剂等。某学习小组设计了如图所示的装置(夹持和加热仪器省略)制备无水四氯化锡。反应原理是Sn+2Cl2=SnCl4。
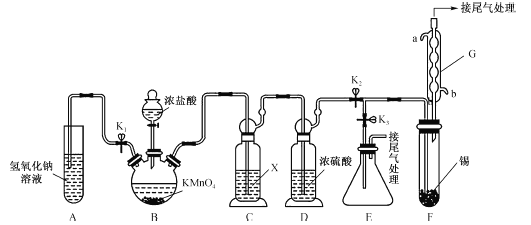
已知:
化学式 | SnCl2 | SnCl4 |
熔点/℃ | 247 | -33 |
沸点/℃ | 623 | 114 |
其他性质 | 无色晶体,易被氧化 | 无色液体,易水解 |
请回答下列问题:
(1)装置G的名称为__________,该装置的进水口为__________(填“a”或“b”)。
(2)装置B中发生反应的离子方程式为__________。
(3)装置C的作用是除去氯化氢,所用试剂X的名称是_________。
(4)按图连接好装置,检查装置气密性,关闭K1、K3,打开K2,慢慢滴入浓盐酸,待观察到装置F内充满黄绿色气体后,开始加热装置F,当装置F中的固体完全消失,充满SnCl4气体时,将生成的SnCl4排入接收器E中的操作是:停止加热装置F,关闭分液漏斗活塞,__________,再用洗耳球从G的上出口向装置内吹气。
(5)某同学认为装置F中的反应可能产生SnCl2杂质。下列试剂中,可用于检测反应是否产生了SnCl2的有__________(填字母)。
a.FeCl3溶液(滴有KSCN) b.H2O2溶液 c.溴水 d.AgNO3溶液
(6)SnCl4能溶解一定量的氯气,若制取3 kg SnCl4(含氯气的质量分数为13.0%,假设不含除氯气外的其他杂质),则至少需通入氯气的体积(标准状况下)是__________m3(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丹参醇是存在于中药丹参中的一种天然产物。合成丹参醇的部分路线如下:
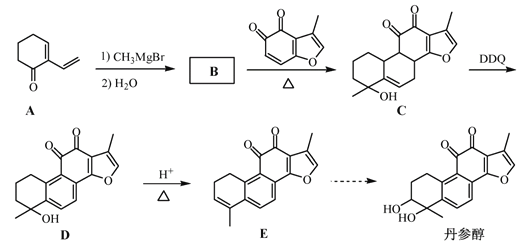
已知: 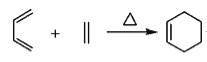
(1)C中的含氧官能团名称为羟基、_____和______。
(2)D![]() E的反应类型为__________________。
E的反应类型为__________________。
(3)B的分子式为C9H14O,写出B的结构简式:__________________。
(4)写出以![]() 和
和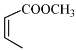 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)________________。
的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,发生反应:PCl5(g)![]() PCl3(g)+Cl2(g) ΔH=a kJ·mol-1(a>0)。0~10 min保持容器温度不变,10 min时改变一种条件,整个过程中PCl5、PCl3、Cl2的物质的量随时间的变化如图所示。
PCl3(g)+Cl2(g) ΔH=a kJ·mol-1(a>0)。0~10 min保持容器温度不变,10 min时改变一种条件,整个过程中PCl5、PCl3、Cl2的物质的量随时间的变化如图所示。
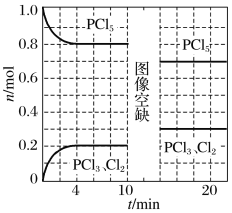
下列说法正确的是
A.0~4 min的平均速率v(PCl3)=0.025 mol·L-1·min-1
B.10 min时改变的条件是增加了一定量的PCl5
C.若起始时向该容器中充入2.0 mol PCl3和2.0 mol Cl2,保持温度为T,反应达平衡时放出的热量小于1.6a kJ
D.温度为T,起始时向该容器中充入1.0 mol PCl5、0.10 mol PCl3和0.10 mol Cl2,反应达到平衡前v正<v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)碱金属元素原子最外层的电子都是_______个,在化学反应中它们容易失去_______个电子;卤族原子最外层的电子都是_______个,在化学反应中它们得到_______个电子。
(2)用电子式表示:N2_____________,CH4__________________,KCl_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氯的盐NaClO2是一种重要的含氯消毒剂。以下是过氧化氢法生产NaClO2的工艺流程图:
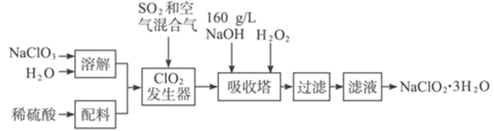
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
②ClO2的沸点为283 K,纯ClO2易分解爆炸,常用稀有气体或空气稀释防止爆炸性分解
(1)NaClO2 的名称为_______________
(2)ClO2发生器中所发生反应的化学方程式为_______________,发生器中鼓入空气的作用可能是_______________(选填序号)。
a.将SO2氧化成SO3,增强酸性; b.稀释ClO2以防止爆炸; c.将NaClO3氧化成ClO2
(3)吸收过程中所用还原剂的还原性应适中,原因是_________,除H2O2外,还可以选择的还原剂是____________(填序号)
A.Na2O2 B.Na2S C.FeCl2 D.KMnO4
(4)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是____________(选填序号)。
A.蒸馏 B.蒸发 C.灼烧 D.过滤 E.冷却结晶
(5)将所得的NaClO2·3H2O晶体用冰水洗涤烘干,如何确定该晶体洗涤干净?
________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中氮氧化物和碳氢化合物受紫外线作用可产生二次污染物光化学烟雾,其中某些反应过程如图所示。下列说法不正确的是( )

A. NO2不是酸性氧化物B. O2和O3是氧的两种同素异形体
C. 反应I属于氧化还原反应D. 烟雾是一种固溶胶,其分散剂是空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)微型纽扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn+2OH--2e-===ZnO+H2O,Ag2O+H2O+2e-===2Ag+2OH-。根据上述反应式,完成下列题目。

(a)下列叙述正确的是________。
A.在使用过程中,电解质溶液的pH增大
B.使用过程中,电子由Ag2O极经外电路流向Zn极
C.Zn是负极,Ag2O是正极
D.Zn电极发生还原反应,Ag2O电极发生氧化反应
(b)写出电池的总反应式:___________________。
(2)某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
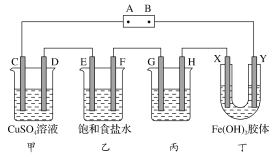
(a)电源A极的名称是________。
(b)甲装置中电解反应的总化学方程式:___________
(c)如果收集乙装置中产生的气体,两种气体的体积比是________。
(d)欲用丙装置给铜镀银,G应该是________(填“铜”或“银”)。
(e)装置丁中的现象是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com