解答:解:前四周期元素A、B、C、D、E、F,原子序数依次增大,A和B同周期,固态的AB
2能升华,AB
2为CO
2,则A为碳元素,B为氧元素;E原子的一个电子后3p轨道全充满,则E最外层电子数为7,故E为氯元素;C和E原子都有一个未成对电子,C
+比E
-少一个电子层,则C为钠元素;D的最高化合价和最低化合价代数和为4,D最外层电子数为6,D原子序数大于钠元素小于氯元素,故D为硫元素,其最高价氧化物SO
3中S的质量分数为40%,且核内质子数等于中子数,符合题意;F为红色单质,广泛用于电气工业,F为铜元素.
(1)D为硫元素,E为氯元素,同周期自左而右,元素电负性增强,所以电负性D<E.
故答案为:<.
(2)A为碳元素,B为氧元素;碳单质金刚石为原子晶体,氧气形成分子晶体,所以熔点A>C.
故答案为:>.
(3)A为碳元素,E为氯元素,AE
4为CCl
4,碳原子最外层电子全部成键,成4个C-Cl键,碳原子杂化轨道数为4,采取SP
3杂化,属于分子晶体.
故答案为:SP
3;分子晶体.
(4)F为铜元素,核外电子数为29,F的核外电子排布式为1s
22s
22p
63s
23p
63d
104s
1;向F的硫酸盐中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出蓝色晶体,该晶体为[Cu(NH
3)
4]SO
4?H
2O,晶体中铜离子与NH
3之间的化学键为配位键.
故答案为:1s
22s
22p
63s
23p
63d
104s
1;配位键.
(5)B为氧元素、D为硫元素,对应氢化物为水与硫化氢,水分子间存在氢键,增大分子间作用力,所以氢化物的沸点:B比D高.
故答案为:水分子间存在氢键,增大分子间作用力.
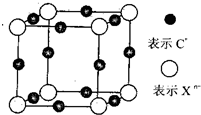
(6)由CnX晶体的最小结构单元可知,该晶体晶胞中X
n-数目为8×
=1,C
+数目为12×
=3,所以晶体中阳离子和阴离子个数比为3:1;以右边前面顶点的X
n-研究,三条棱向上、向前、向右延伸,还有3个距离的C
+离子,所以晶体中每个X
n-被6个等距离的C
+离子包围.
故答案为:3:1;6.

 (2009?深圳二模)前四周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子的一个电子后3p轨道全充满;D的最高化合价和最低化合价代数和为4,其最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,广泛用于电气工业.回答下列问题:
(2009?深圳二模)前四周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子的一个电子后3p轨道全充满;D的最高化合价和最低化合价代数和为4,其最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,广泛用于电气工业.回答下列问题:
