
 为探究测定中和热的实验,小明利用50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液,在如图所示的装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热(中和热数值为57.3kJ/mol).
为探究测定中和热的实验,小明利用50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液,在如图所示的装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热(中和热数值为57.3kJ/mol).分析 (1)根据中和热是强酸和强碱的稀溶液完全反应生成1mol水放出的热量,标注物质聚集状态和对应焓变写出热化学方程式进行解答;
(2)中和热测定实验成败的关键是保温工作;
(3)为了确保定量的HCl反应完全,所用NaOH稍过量;反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(4)根据实验的关键是保温,如果装置有能量散失,则会导致结果偏低,根据实验中用到的试剂以及实验操作知识来判断.
解答 解:(1)稀的强酸与强碱溶液反应的中和热数值为57.3kJ/mol,则稀盐酸与稀NaOH溶液中和反应的热化学方程式:HCl (aq)+NaOH (aq)=H2O (l)+NaCl (aq)△H=-57.3kJ/mol;
故答案为:HCl (aq)+NaOH (aq)=H2O (l)+NaCl (aq)△H=-57.3kJ/mol;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是保温隔热、减少热量损失;
故答案为:保温隔热、减少热量损失;
(3)实验中,所用NaOH稍过量的原因是确保定量的HCl反应完全;反应放出的热量和所用酸以及碱的量的多少有关,用60mL 0.50mol•L-1盐酸跟50mL 0.55mol•L-1 NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以用60mL 0.50mol•L-1盐酸跟50mL 0.55mol•L-1 NaOH溶液,测得中和热数值相等;
故答案为:确保定量的HCl反应完全;相等;因中和热是指稀强酸与稀强碱发生中和反应生成1 mol H2O放出的热量,与酸碱的用量无;
(4)A.测量盐酸的温度后,温度计没有用水冲洗干净,在测碱的温度时,会发生酸和碱的中和,温度计示数变化值减小,导致实验测得中和热的数值偏小,故A正确;
B、做本实验的室温和反应热的数据之间无关,故B错误;
C、将量筒中的NaOH(aq)倒入小烧杯时动作迟缓,会导致一部分能量的散失,导致实验测得中和热的数值偏小,故C正确;
D、在量取盐酸时仰视读数,会使得实际量取体积高于所要量的体积,算过量,可以保证碱全反应,导致实验测得中和热的数值偏高,故D错误;
E、大烧杯的盖板中间小孔太大,会导致一部分能量散失,所以测的数值降低,故E正确.
故答案为:A C E.
点评 本题主要考查了中和热的测定,注意中和热与酸、碱的物质的量无关,可以根据所学知识进行回答,难度不大.


 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:选择题
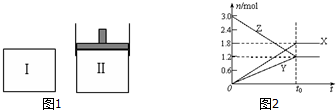
| A. | 该反应的化学方程式为:3X+2Y?2Z | |
| B. | 若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间小于t0 | |
| C. | 若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态 | |
| D. | 若达平衡后,对容器Ⅱ升高温度时,其体积增大,说明Z发生的反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测量中和热时不能用金属棒搅拌混合溶液 | |
| B. | 中和热不是一个定值,其大小由中和反应所消耗的酸和碱的多少决定 | |
| C. | 50mL0.5mol/LHCl和50mL0.55mol/LNaOH溶液反应测定中和热,计算式为△H=$\frac{4.18×100}{0.025}$×△tKJ/mol (注:△t-温度平均变化量) | |
| D. | 为了减少误差,量取稀NaOH溶液后,立即用同一个量筒量取稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 操作 | |
| A | 用苯萃取碘水中碘后,静置后取出有机层 | 先从分液漏斗下端管口放出下层液体,关闭活塞,换一个接收容器,再继续从分液漏斗下端管口放出上层液体 |
| B | 配制500mL2mol/L的氯化铵溶液 | 用托盘天平称取53.5g氯化铵晶体放入500mL容量瓶,加少量水,振荡后再加水至刻度线 |
| C | 测定氯水的pH | 用玻璃棒蘸取少量溶液滴于pH试纸中央,片刻后与标准比色卡对照 |
| D | 用标准盐酸滴定未知浓度的NaOH溶液(含酚酞) | 左手控制酸式滴定管活塞使液体滴下,右手不断振荡锥形瓶,眼睛要始终观察锥形瓶中溶液颜色变化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位物质的量的气体所占的体积就是气体摩尔体积 | |
| B. | 通常状况(室温、101kP)下,气体摩尔体积约为22.4L/mol | |
| C. | 标准状况(0℃、101kP)下,气体摩尔体积约为22.4 L | |
| D. | 标准状况(0℃、101kP)下,1 mol H2O的体积是22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
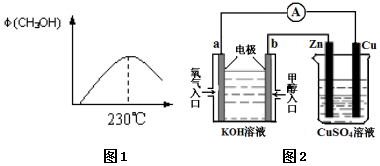 能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一.
能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/L甲酸溶液中c(H+)约为1×10-2mol/L | |
| B. | 甲酸能与水以任意比互溶 | |
| C. | 10mL 1mol/L甲酸恰好跟10 mL 1mol/L NaOH溶液完全反应 | |
| D. | 甲酸的导电性比强酸溶液的导电性弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com