
【题目】升高温度时,化学反应速率加快原因的合理解释是
A.该化学反应的过程是吸热的
B.该化学反应的过程是放热的
C.分子运动速率加快,使反应物分子的碰撞机会增多
D.反应物分子的能量增加,活化分子百分数增加,有效碰撞次数增多
科目:高中化学 来源: 题型:
【题目】烃A是一种重要的化工原料。已知A在标准状况下的密度为1.25 g·L-1,B、D是生活中常见的两种有机物。它们之间的转化关系如下图所示:
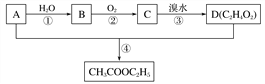
请回答:
(1)有机物A的结构简式为________________________,有机物C中含有的官能团的名称是________。
(2)第③步反应生成D的同时还生成HBr,写出该步反应的化学方程式:___________________。
(3)下列说法正确的是________。
a.石油裂解是工业上大量获得烃A的主要方法
b.相同条件下,有机物B与钠反应比水与钠反应更剧烈
c.用浓NaOH溶液可除去混在乙酸乙酯中的B、D杂质
d.有机物A与D在一定条件下生成乙酸乙酯的反应属于加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程所放出的热量可计算中和热。回答下列问题:
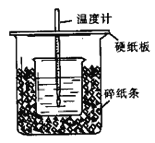
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________________。
(2)烧杯间填满碎纸条的作用__________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 ___________(“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 ________( “变多”“变少”“不变”),所求中和热_______(“相等、不相等”)
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会_____________(“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】21世纪是钛的世纪.在800℃~1000℃时电解TiO2可制得钛,装置如图所示.下列叙述正确的是( ) 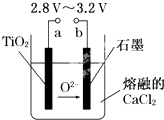
A.a为电源的正极
B.石墨电极上发生还原反应
C.阴极发生的反应为:TiO2+4e﹣═Ti+2O2﹣
D.每生成0.1mol钛,转移电子0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为V L的密闭容器中通入amolCO和bmolO2,一定条件下反应后容器内碳原子数和氧原子数之比为
A. a︰b B. a︰2b C. a︰(a+2b) D. a︰2(a+2b)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施能提高合成氨[N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol]厂的生产效率和经济效益的是
2NH3(g) ΔH=-92.4 kJ/mol]厂的生产效率和经济效益的是
①采用20 MPa~50 MPa的压强;②使用催化剂;③在合适的温度下进行反应;④从平衡混合气体中液化分离出NH3,并将N2、H2循环使用
A. ①③④ B. ③④ C. ①②③ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由铜片、锌片和200mL稀H2SO4组成的原电池中(如图所示装置),请按要求填空:
(1)为正极,发生反应(“氧化”或“还原”),现象是 , 电极反应式为;为负极,发生反应(“氧化”或“还原”),现象是 , 电极反应式为 .
(2)H+向极移动,电子流动方向为→导线→(填电极材料)
(3)若锌片只发生电化学反应,则当铜片上共放出3.36L(标准状况)气体时,H2SO4恰好完全消耗.求:
①反应中消耗的锌的质量
②有个电子通过了导线.
③原稀H2SO4的物质的量浓度是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com