
| A. | 氯化钠溶液在电流作用下电离成钠离子和氯离子的过程叫电离 | |
| B. | 凡溶于水后能电离出氢离子的化合物都是酸 | |
| C. | 二氧化碳溶于水后能导电,故二氧化碳属于电解质 | |
| D. | 硫酸钡难溶于水,但溶解部分完全电离,故硫酸钡是强电解质 |
分析 A.电离不需要通电,据此解答;
B.溶于水后电离出阳离子全部是氢离子的化合物是酸;
C.二氧化碳的水溶液不是本身导电;
D.强电解质指在水溶液中或熔融状态下,能完全电离.
解答 解:A.氯化钠溶液在水分子的作用下电离成钠离子和氯离子,无须通电,通电是电解氯化钠溶液,产物为氢氧化钠和氢气和氯气,故A错误;
B.硫酸氢钠是盐,但在水中能电离出氢离子,故B错误;
C.二氧化碳溶于水后,能和水反应生成碳酸,碳酸能电离出自由移动的阴阳离子,但电离出阴阳离子的是碳酸,不是二氧化碳,所以二氧化碳是非电解质,故C错误;
D.强电解质指在水溶液中或熔融状态下,能完全电离,硫酸钡属于强电解质,虽在水溶液中很难溶解,但溶于水的部分能完全电离,故D正确;
故选:D.
点评 本题涉及电离的实质、酸的概念、强电解质的概念已知电解质的概念等知识,属于基本知识的考查,难度不大.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验用品 | 溶液温度 | 中和热 | ||
| t1 | t2 | △H | ||
| ① | 50 mL0.55 mol•L-1NaOH溶液 | 20℃ | 23.3℃ | |
| 50 mL0.5 mol•L-1HCl溶液 | ||||
| ② | 50 mL0.55 mol•L-1NaOH溶液 | 20℃ | 23.5℃ | |
| 50 mL0.5 mol•L-1HCl溶液 | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、醛基-CHO、羧基-COOH、-COOR酯基.
、醛基-CHO、羧基-COOH、-COOR酯基.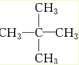 ,名称为2,2-二甲基丙烷.
,名称为2,2-二甲基丙烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水和碘化钾反应:Cl2+I-═Cl-+I2 | |
| B. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| C. | 氯气和水反应:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HX、HY、HZ的酸性依次增强 | |
| B. | 溶液中的离子浓度c(X-)<c(Y-)<c(Z-) | |
| C. | 电离常数K(HY)>K(HZ),水解常数K(Y-)>K(Z-) | |
| D. | c(X-)=c(Y-)+c(HY)=c(Z-)+c(HZ) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸发法进行海水淡化 | |
| B. | 用酒精萃取碘水中的碘 | |
| C. | 用渗析的方法除去淀粉溶液中含有的少量NaCl | |
| D. | 用加热→蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-、NO3-、Ba2+、Cl- | B. | Na+、Ba2+、Cl-、NO3- | ||
| C. | K+、NH4+、Cl-、OH- | D. | Na+、K+、SO42-、I- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com