
| A. | ③④ | B. | ②③ | C. | ①② | D. | ②④ |
分析 分子中含7个碳原子的芳香烃只能是甲苯,没有同分异构体,烷烃的一氯取代物只有一种,说明该烷烃中只有一种等效氢原子,根据等效氢原子的判断方法来回答.
解答 解:分子中含7个碳原子的芳香烃只能是甲苯,没有同分异构体,不符合,此题有两个限制条件,满足第一个条件只要是含4个碳原子及其以上即可,满足第二个条件的烷烃烃分子中,同一个碳上的氢原子等效,连在同一个碳原子上的氢原子等效,具有镜面对称的碳原子上的氢原子等效,烷烃的一氯取代物只有一种,说明该烷烃中只有一种等效氢原子,符合这些条件的烷烃有:甲烷、乙烷、新戊烷、2,2,3,3-四甲基丁烷等.综合起来,③④正确.
故选A.
点评 本题考查同分异构体的书写,题目难度不大,掌握等效氢原子的判断是解题的关键.


科目:高中化学 来源: 题型:选择题
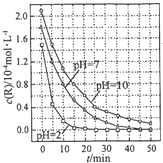
| A. | 在0-50min之间,pH=2 和 pH=7 时 R 的降解百分率相等 | |
| B. | 溶液酸性越强,R 的降解速率越小 | |
| C. | R的起始浓度越小,降解速率越大 | |
| D. | 在 20-25min之间,pH=10 时 R 的平均降解速率为 0.04mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为c(Cl-)>c(NH+4)>c(H+)>c(OH-) | |
| B. | 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| C. | 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 | |
| D. | 将pH=4的醋酸溶液和pH=10的氢氧化钠溶液等体积混合,所得溶液的pH一定大于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
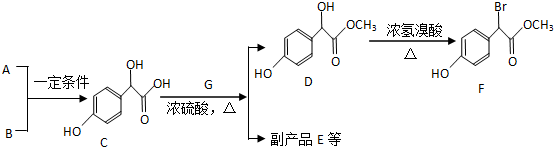
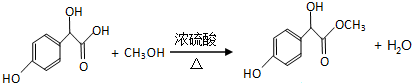
 .
.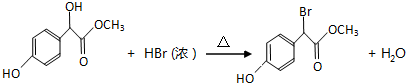
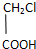
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,在水中的溶解度:丙三醇>苯酚>1-氯丁烷 | |
| B. | 乙二酸俗称草酸,具有还原性,可以使酸性高锰酸钾溶液褪色 | |
| C. | 银氨溶液和氢氧化铜悬浊液可以较长时间存放 | |
| D. | 油脂在酸性或碱性条件下均可发生水解反应,且产物不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. (或
(或 )(写出任一种的结构简式).
)(写出任一种的结构简式). .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
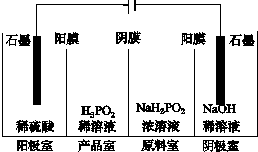 次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
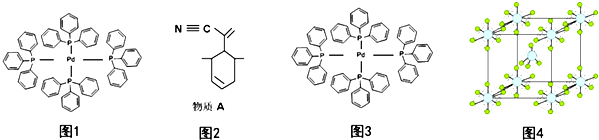
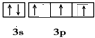 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com