
【题目】某课外小组在实验室模拟工业上从浓缩海水中提取溴的工艺流程,设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去)。下列说法错误的是

A.装置中通入的是a气体是Cl2
B.实验时应在A装置中通入a气体一段时间后,停止通入,改通入热空气
C.B装置中通入a气体前发生的反应为SO2+ Br2+2H2O===H2SO4+2HBr
D.C装置的作用只是吸收多余的二氧化硫气体
【答案】D
【解析】
实验室模拟工业上从浓缩海水中提取溴,由实验装置可知,a中气体为氯气,在A中氯气可氧化溴离子,利用热空气将溴单质吹出,B中通入气体为二氧化硫,在B中发生SO2+Br2+2H2O=H2SO4+2HBr,c中NaOH溶液可吸收溴、氯气、二氧化硫等尾气,以此来解答。
A.A装置中通入的a气体是Cl2,目的是氧化A中溴离子,故A正确;
B.实验时应在A装置中通入a气体一段时间后,停止通入,改通入热空气,热空气将溴单质吹出,故B正确;
C.B装置中通入b气体后发生的反应为SO2+Br2+2H2O=H2SO4+2HBr,故C正确;
D.C装置的作用为吸收溴蒸汽、氯气、二氧化硫等尾气,故D错误;
所以本题答案:D。


科目:高中化学 来源: 题型:
【题目】如图为某学校实验室浓硫酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:

(1)该浓硫酸的物质的量浓度为____________。
(2)某学生欲用上述浓硫酸和蒸馏水配制480 mL 0.500 molL-1稀硫酸。
①配制稀硫酸时,选用仪器有量筒、烧杯、玻璃棒、__________。
②该学生需要用量筒量取__________mL,上述浓硫酸进行配制。
(3)在配制过程中,下列实验操作对所配制的稀硫酸的物质的量浓度有何影响?(填“偏大”“偏小”或“无影响”)。
①用量筒量取浓硫酸时仰视观察凹液面:__________。
②定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水:__________。.
(4)该同学将所配制的0.500 molL-1的硫酸溶液逐滴滴加到0. 500 molL-1 Ba(OH)2 溶液中,产生沉淀的质量与加入硫酸体积关系如图所示:
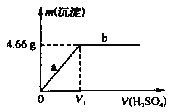
①该反应的离子方程式为_______________。
②充分反应后生成沉淀质量为4. 66 g,则消耗Ba(OH)2溶液的体积为________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水杨酸的结构简式为![]() ,水杨酸酯E为紫外吸收剂,可用于配制防晒霜。E的一种合成路线如下:
,水杨酸酯E为紫外吸收剂,可用于配制防晒霜。E的一种合成路线如下:
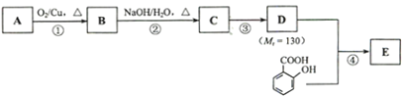
已知:2RCH2CHO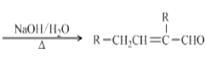 。回答下列问题:
。回答下列问题:
(1)饱和一元醇A中氧的质量分数约为21.6%,则A的分子式为________;结构分析显示A只有一个甲基,A的名称为_____。
(2)第③步的反应类型为____; D中所含官能团的名称为______;
(3)第①步反应的化学方程式为______。
(4)E的分子式是______。
(5)1mol水杨酸分别消耗NaOH、NaHCO3的物质的量之比是______。
(6)X是比水杨酸多一个碳原子的同系物。X的同分异构体中,符合下列条件的共__种,其中取代基在苯环的对位且能消耗3molNaOH的同分异构体的结构简式是_______。①苯环上有两个取代基②与FeCl3发生显色反应③能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。
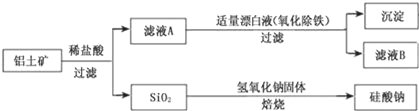
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:__Fe2+___ClO-+( )___=____Fe(OH)3↓+__C1﹣+( )。
②检验滤液B中是否还含有铁元素的方法为:________(注明试剂、现象)。
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为___(填代号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、____(填操作名称)、洗涤。
(2)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为___(填代号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国某地粉煤灰中镓含量丰富,其主要成分以Ga2O3的形式存在,除此之外还含有A12O3、Fe3O4、SiO2等杂质。已知从粉煤灰中回收镓的艺流程如图甲所示。

信息:(i)转型液中镓以GaO2-的形式存在;
(ii)Ksp[Ga(OH3)]=1.4×10-34,Ksp[Fe(OH)3]=2.7×10-39,Ksp[Fe(OH)2]=4.87×10-17。
回答下列问题:
(1)滤渣A中一定含有的成分是___________。
(2)“氧化”过程中加入H2O2的目的是___________,该过程中发生反应的离子方程式为___________。
(3)洗脱液中还有少量的Fe3+、Ga3+,其中Ga3+浓度为1.4×10-4mol/L,列式计算当Fe3+恰好沉淀完全时[c(Fe3+)≤1.0×10-5mol/L],G a3+是否开始沉淀___________。
(4)流程图中两次调节pH的目的分别是___________。
(5)电解法可以提纯粗镓,具体原理如图乙所示①粗镓与电源___________极相连(填“正”或“负”)。②镓在阳极溶解生成的Ga3+与NaOH溶液反应生成GaO2-,GaO2-在阴极放电的电极反应式为___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,二元弱酸 H2Y 溶液中滴加 KOH 溶液,所得混合溶液的 pH 与离子浓度变化的关系如下图所示,下列有关说法错误的是

A. 曲线 M 表示 pH与 lg![]() 的变化关系
的变化关系
B. a点溶液中:c(H+) ― c(OH-)=2c(Y2-)+c(HY-) ― c(K+)
C. H2Y 的第二级电离常数Ka2(H2Y)=10-4.3
D. 交点b的溶液中:c(H2Y)=c(Y2-)>c(HY-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,请回答下列问题:

(1)该“84消毒液”的物质的量浓度约为________molL-1。(保留2位有效数字)
(2)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是________(填字母).
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器

B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0g
(3)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84gcm-3)的浓硫酸配制200mL 2.3 molL-1的稀硫酸用于增强“84消毒液”的消毒能力。
①需要量取浓硫酸的体积为________mL;(保留2位有效数字)
②定容时向容量瓶中注入蒸馏水,液面离刻度线下________时,改用胶头滴管滴加蒸馏水至________相切;
③在转移液体前需要注意的是(容量瓶已查漏且洗涤干净)________________________;
④下列操作会使配制的稀硫酸物质的量浓度偏大的是________;
A.容量瓶用蒸馏水洗涤后残留有少量的水
B.量取浓溶液读数时仰视刻度线
C.移液时玻璃棒在刻度线以上
D.定容观察液体时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g)===2HF(g) ΔH=-270 kJ/mol,下列说法正确的是( )
A.氟化氢气体分解生成氢气和氟气的反应是放热反应
B.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
D.该反应中的能量变化可用如图来表示

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl是我们生活中必不可少的物质。将NaCl溶于水配成1 mol·L-1的溶液,溶解过程如图所示,下列说法正确的是
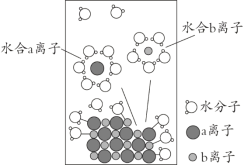
A. a离子为Na+
B. 溶液中含有NA个Na+
C. 水合b离子的图示不科学
D. 室温下测定该NaCl溶液的pH小于7,是由于Cl-水解导致
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com