
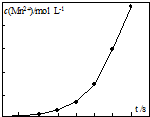
 草酸钠滴定法测定高锰酸钾的质量分数步骤如下:
草酸钠滴定法测定高锰酸钾的质量分数步骤如下:分析 (1)滴定终点,溶液颜色发生变化,且半分钟内颜色不变;
(2)根据反应Na2C2O4+H2SO4→H2C2O4(草酸)+Na2SO4 5H2C2O4+2MnO4-+6H+→2Mn2++10CO2↑+8H2O找出关系式,然后结合题中数据计算;
(3)加热温度大于90℃,部分草酸发生分解,消耗高锰酸钾溶液的体积减少;
(4)反应中Mn2+浓度发生显著变化,应是反应生成的Mn2+对反应有催化作用.
解答 解:(1)滴定终点时的现象为:当最后一滴KMnO4溶液滴入后,溶液由无色变为红色,且半分钟不褪色,
故答案为:无色变为紫色且半分钟不褪色;
(2)根据反应Na2C2O4+H2SO4→H2C2O4(草酸)+Na2SO4 5H2C2O4+2MnO4-+6H+→2Mn2++10CO2↑+8H2O可得关系式:5Na2C2O4~2KMnO4,
设配制的8.48mL配制的样品溶液中含有高锰酸钾的质量为x,
则:5Na2C2O4~2KMnO4,
134×5 2×158
0.2014g x
x=$\frac{158×2×0.2014g}{134×5}$=0.0950g,
50mL该样品溶液中含有高锰酸钾的质量为:0.0950g×$\frac{50mL}{8.48mL}$=0.560g,
则样品中高锰酸钾的质量分数为:$\frac{0.560g}{0.80g}$=0.700g,
故答案为:0.700;
(3)加热温度大于90℃,部分草酸发生分解,消耗高锰酸钾溶液的体积减少,会导致测得产品纯度偏高,
故答案为:偏高;
(4)反应中Mn2+浓度发生显著变化,应是反应生成的Mn2+对反应有催化作用,且c(Mn2+)浓度大催化效果更好,
故答案为:Mn2+可能是该反应的催化剂,随着Mn2+的产生,反应速率大大加快.
点评 本题考查物质含量的测定,题目难度中等,涉及氧化还原反应滴定等知识,注意把握实验的原理,需要学生具备一定的理论分析能力和计算解决问题的能力.


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:解答题
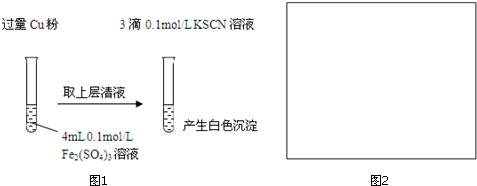
| 实验方案 | 现象 | 结论 |
| 步骤1:取4mL0.1mol/L CuSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液 | 产生白色沉淀 | CuSO4与KSCN反应产生了白色沉淀 |
| :步骤2:取取4mL 0.1mol/L FeSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液 | 无明显现象 |
| 实验方案 | 现象 |
| 向3mL 0.1mol/L FeSO4溶液中加入1mL 8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使湿润淀粉-KI试纸变蓝色的气体必为氯气 | |
| B. | 氟气与熔融状态下氯化钠反应可产生氯气 | |
| C. | 易见光分解的AgNO3晶体,应存放于棕色细口试剂瓶中 | |
| D. | 溴水应存放在胶头滴瓶(棕色)中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X难溶于乙醇 | |
| B. | 酒中的少量丁酸能抑制X的水解 | |
| C. | 分子式为C4H8O2且官能团与X相同的物质共有5种 | |
| D. | X完全燃烧后生成CO2和H20的物质的量比为1:2. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO?) | |
| B. | 常温下,pH=2的CH3COOH溶液与pH=12的NaOH 溶液等体积混合后溶液的pH=7 | |
| C. | CH3COOH溶液中加入少量CH3COONa固体.平衡逆向移动 | |
| D. | 室温下向pH=3的醋酸溶液中加水稀释,溶液中$\frac{[C{H}_{3}CO{O}^{-}]}{[C{H}_{3}COOH][O{H}^{-}]}$不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由0.1 mol/L一元碱BOH溶液的pH=10,可推知溶液存在BOH=B++OH- | |
| B. | 醋酸溶于水并达到电离平衡后,加水稀释,则溶液中的c(OH-)减小 | |
| C. | pH=3的醋酸加水稀释后,CH3COOH电离程度增大,醋酸电离常数不变 | |
| D. | 醋酸在醋酸钠溶液中的电离程度大于纯水中的电离程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示,已知Ksp(CaSO4)=9×10-6.下列说法不正确的是( )
常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示,已知Ksp(CaSO4)=9×10-6.下列说法不正确的是( )| A. | a点对应的Ksp等于c点对应的Ksp | B. | 加入Na2SO4溶液可以使a点变为b点 | ||
| C. | a点变为b点将有沉淀生成 | D. | d点未达到沉淀溶解平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某吸热反应能自发进行,因此该反应是熵增反应 | |
| B. | 加入NaHCO3使氯水的漂白能力增强 | |
| C. | 难溶电解质可以由溶解度小的转化为溶解度更小的,但不能从溶解度小的转化为溶解度大的 | |
| D. | Ksp只受温度的影响,不受浓度的影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com