

 在一定条件下可水解为
在一定条件下可水解为 ;则F
;则F ,B与浓硝酸发生取代反生成C,则B为
,B与浓硝酸发生取代反生成C,则B为 ,A发生氧化反应生成B,D中硝基被还原为氨基生成E,E与CH3CH2CH2COCl发生取代反应生成F,
,A发生氧化反应生成B,D中硝基被还原为氨基生成E,E与CH3CH2CH2COCl发生取代反应生成F, ,B与浓硝酸发生取代反生成C,则B为
,B与浓硝酸发生取代反生成C,则B为 ,A发生氧化反应生成B,D中硝基被还原为氨基生成E,E与CH3CH2CH2COCl发生取代反应生成F,
,A发生氧化反应生成B,D中硝基被还原为氨基生成E,E与CH3CH2CH2COCl发生取代反应生成F, ,B的分子式为C8H8O2;A的名称是间二甲苯,故答案为:C8H8O2;间二甲苯;
,B的分子式为C8H8O2;A的名称是间二甲苯,故答案为:C8H8O2;间二甲苯; +CH3OH
+CH3OH| 浓H2SO4 |
| △ |
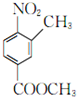 +H2O,故答案为:
+H2O,故答案为: +CH3OH
+CH3OH| 浓H2SO4 |
| △ |
 +H2O;
+H2O;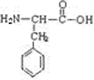 ,
, ;
; 在一定条件下可水解为
在一定条件下可水解为 ;则F在强酸和长时间加热条件下发生水解反应,水解生成
;则F在强酸和长时间加热条件下发生水解反应,水解生成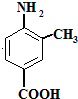 、CH3CH2CH2COOH、CH3OH,故答案为:
、CH3CH2CH2COOH、CH3OH,故答案为: 、CH3CH2CH2COOH、CH3OH.
、CH3CH2CH2COOH、CH3OH.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
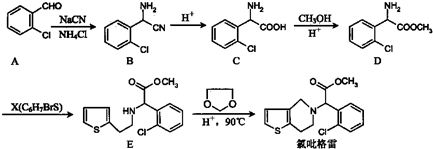
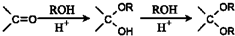
 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选).
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 一系列 |
| 操作 |
| ①酸性高锰酸钾 |
| ②(NH4)2Fe(SO4)2 |
| 标准溶液滴定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al起始反应的离子方程式为2Al+6H+=2Al3++3H2↑ |
| B、滤液I中一定含有Cu2+、Al3+;一定含有Fe2+和Fe3+中的一种或两种 |
| C、滤渣I的主要成分是Au与Pt,由此可以回收贵重的金属 |
| D、加入稀硫酸可以提高硝酸的利用率,使硝酸根离子完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、比较NaHCO3和Na2CO3热稳定性大小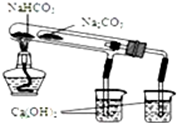 |
B、用铜和稀硝酸制取并收集少量NO |
C、验证氨气在水中溶解度的大小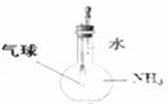 |
D、实验室用氯化铵制少量氨气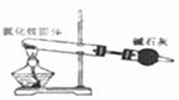 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实 验 操 作 及 现 象 | 实 验 结 论 |
| A | 将水蒸气通过灼热的铁粉,粉末变红褐色 | 铁与水在高温下发生反应 |
| B | 向某溶液中加入几滴新制的氯水,再加入2滴KSCN溶液,溶液变为红色 | 原溶液中不一定含有Fe2+ |
| C | 将某气体通入酸性高锰酸钾溶液中,溶液紫色褪去 | 该气体有还原性 |
| D | 用PH试纸测定NaClO溶液的酸碱性,试纸显蓝色 | NaClO水解显碱性 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
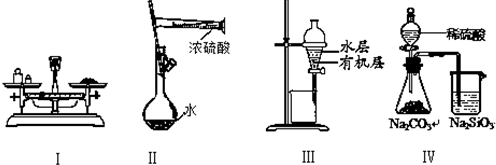
| A、实验Ⅰ:用托盘天平称量一定质量的氯化钠固体 |
| B、实验Ⅱ:配制一定物质的量浓度的硫酸 |
| C、实验Ⅲ:用苯萃取溴水中的溴后进行分液 |
| D、实验Ⅳ:比较硫酸、碳酸和硅酸酸性强弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com