
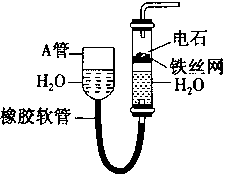
 如图中的实验装置可用于制取乙炔.请填空:
如图中的实验装置可用于制取乙炔.请填空:分析 图示装置可通过调节A管的高度,控制反应的发生和停止:将A管提高,右管中水面上升,与电石接触发生反应;将A管降低,右管中水面下降,水与电石脱离接触,反应停止,则制取乙炔的化学反应方程式为CaC2+2H2O→Ca(OH)2+CH≡CH↑,乙炔含有C≡C键,可发生加成、加聚和氧化反应,
(1)实验室通过电石与水的反应制取乙炔;
(2)可以用饱和食盐水来代替纯水从而减缓反应速率;
(3)乙炔能使酸性高锰酸钾溶液褪色,发生了氧化反应;
(4)乙炔能够和溴水发生加成反应;
(5)乙炔是可燃性气体,可燃性气体在点燃前必须检验其纯度,以免发生爆炸.
解答 解:(1)实验室通过电石与水的反应制取乙炔,制取乙炔的化学反应方程式为CaC2+2H2O→Ca(OH)2+CH≡CH↑,
故答案为:CaC2+2H2O→Ca(OH)2+CH≡CH↑;
(2)为避免反应太迅速,可以用饱和食盐水来代替纯水从而减缓反应速率;
故答案为:用饱和食盐水来代替纯水;
(3)乙炔容易被高锰酸钾氧化,使酸性高锰酸钾褪色,
故答案为:酸性高锰酸钾溶液褪色;
(4)乙炔含有C≡C键,可发生加成,乙炔能够和溴的CCl4溶液中的溴单质发生加成反应,
故答案为:加成;
(5)乙炔燃烧的化学方程式为 2CH≡CH+5O2 $\stackrel{点燃}{→}$4CO2+2H2O;乙炔中含碳的质量分数较大,燃烧时火焰明亮并伴有浓烈的黑烟,乙炔点燃前必须检验其纯度,以免发生爆炸,
故答案为:检验乙炔的纯度.
点评 本题考查乙炔的实验室制法及其性质,侧重基础知识的考查,有利于培养学生的分析能力和实验能力,注意相关基础知识的积累,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 使pH试纸变蓝的溶液中:Fe3+、NH4+、S2-、SO32- | |
| B. | 能与Al反应产生H2的溶液中:HCO3-、Ba2+、Al3+、Br- | |
| C. | 常温下pH=1的溶液中:Mg2+、Cl-、SO42-、Fe3+ | |
| D. | 由水电离出的c(H+)=1×10-13 mol/L的溶液:K+、AlO2-、Br-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
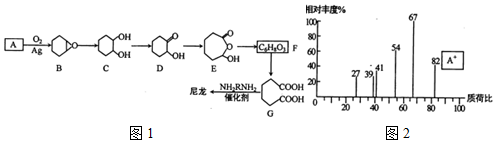
 .
. .
. $\stackrel{Br_{2}}{→}$
$\stackrel{Br_{2}}{→}$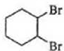 $→_{△}^{NaOH、醇}$
$→_{△}^{NaOH、醇}$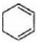 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
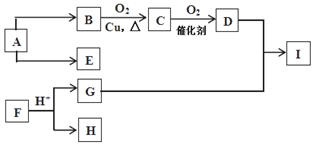
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C7H16主链上有5个碳原子的同分异构体有5种 | |
| B. | 按系统命名法,化合物的名称是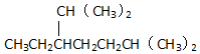 2,6-二甲基-3-乙基庚烷 2,6-二甲基-3-乙基庚烷 | |
| C. | 乙炔分子的球棍模型: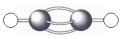 | |
| D. | 卤代烃加入硝酸酸化的硝酸银溶液根据生成的卤化银沉淀颜色检验卤原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com