
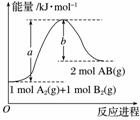
已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,请写出该反应的热化学方程式:________________________________________________________________________
________________________________________________________________________。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列关于微粒半径的叙述中,正确的是( )
A.金属阳离子的半径大于它的原子半径
B.金属阳离子的半径小于它的原子半径
C.非金属阴离子的半径与其原子半径相等
D.非金属阴离子的半径小于其原子半径
查看答案和解析>>
科目:高中化学 来源: 题型:
现有1~20号元素A、B、C、D所对应的物质的性质或微粒结构如下表:
| 元素 | 物质性质或微粒结构 |
| A | M层上有2对成对电子 |
| B | B的离子与D的离子具有相同电子层结构,且可以相互组合形成干燥剂 |
| C | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| D | 元素最高正价是+7价 |
(1)元素A的原子最外层共有________种不同运动状态的电子,有________种能量不同的电子。B的离子与D的离子相互组合形成的干燥剂的化学式是________。
(2)元素C与氢元素形成带一个单位正电荷的离子,写出该微粒的电子式________________________________________________________________________(用元素符号表示)。
(3)元素A与元素D相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________。
A.常温下A的单质和D的单质状态不同
B.A的氢化物比D的氢化物稳定
C.一定条件下D能从A的氢化物水溶液中置换出A单质
D.HD的酸性比HA酸性强
(4)C的氢化物固态时属于________晶体,该氢化物与A的最高价氧化物对应的水化物反应的化学方程式是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下面列举了一些化学键的键能数据,供计算使用。
| 化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
工业上的高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)===Si(s)+4HCl(g),该反应的反应热ΔH为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知Al2O3(s)+AlCl3(g)+3C(s)===3AlCl(g)+3CO(g) ΔH=a kJ·mol-1
判断下列变化过程是否正确,正确的划“√”,错误的划“×”
(1)3AlCl(g)+3CO(g)===Al2O3(s)+AlCl3(g)+3C(s)
ΔH=a kJ·mol-1( )
(2)AlCl(g)+CO(g)===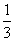 Al2O3(s)+
Al2O3(s)+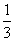 AlCl3(g)+3C(s)
AlCl3(g)+3C(s)
ΔH=-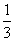 a kJ·mol-1( )
a kJ·mol-1( )
(3)2Al2O3(s)+2AlCl3(g)+6C(s)===6AlCl(g)+6CO(g)
ΔH=-2a kJ·mol-1( )
查看答案和解析>>
科目:高中化学 来源: 题型:
完成下列小题。
(1)[2013·江苏,20(1)]白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)===6CaO(s)+P4(s)+10CO(g) ΔH1=+3 359.26 kJ·mol-1
CaO(s)+SiO2(s)===CaSiO3(s) ΔH2=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)===6CaSiO3(s)+P4(s)+10CO(g) ΔH3
则ΔH3=________kJ·mol-1。
(2)[2013·四川理综,11(5)节选]焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g)2SO3(g)
ΔH1=-197 kJ·mol-1;
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l)
ΔH3=-545 kJ·mol-1。
则SO3(g)与H2O(l)反应的热化学方程式是________。
(3)[2013·浙江理综,27(1)]捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)(NH4)2CO3(aq)ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)NH4HCO3(aq)ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)2NH4HCO3(aq)ΔH3
ΔH3与ΔH1、ΔH2之间的关系是:ΔH3=________。
(4)[2013·天津理综,10(2)①]为减少SO2的排放,常采取的措施有:
将煤转化为清洁气体燃料。
已知:H2(g)+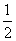 O2(g)===H2O(g)
O2(g)===H2O(g)
ΔH=-241.8 kJ·mol-1
C(s)+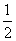 O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式:______________________________________。
(5)[2013·北京理综,26(2)①]汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
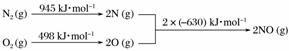
写出该反应的热化学方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示物质的转化关系中,A是一种固体单质,E是一种白色沉淀。
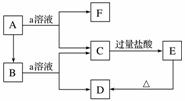
请回答下列问题:
(1)B的化学式是__________,目前B已被用作________的主要原料。
(2)B和a溶液反应的离子方程式是____________________________________________。
(3)A和a溶液反应的离子方程式是__________________________________________。
(4)C和过量的盐酸反应的离子方程式是________________________________________。
审题分析 本题应抓住框图中的转化关系,以题设条件C+过量盐酸—→E(白色沉淀)为突破口进行推断,并结合已有知识进行设定与推测。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com