
如图所示装置中,可观察到电流表指针偏转,M棒变粗,N棒变细.下表所列M、N、P物质中,可以组合成该装置的是( )
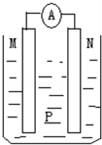
选 项 | M | N | P |
A | 锌 | 铜 | 稀硫酸 |
B | 铜 | 铁 | 稀盐酸 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.A B.B C.C D.D
科目:高中化学 来源:2016届福建省南平市浦城县高考模拟化学试卷(解析版) 题型:选择题
选项 | 相关说法 | 主要原因 |
A | 包装内放置透气的硅胶包,有利于防止食品变质 | 硅胶有强吸水性 |
B | 面粉加工车间悬挂有“严禁烟火”的牌子 | 烟火会污染面粉 |
C | 某些铁制品出厂时在其表面涂上一层油膜可防止其生锈 | 铁被氧化,在其表面形成一层致密的保护膜 |
D | 聚氯乙烯薄膜不能用于包装食品 | 会造成白色污染 |
A.A B.B C.C D.D
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省南通市如皋市高一下期中化学试卷(解析版) 题型:选择题
将7.8g镁铝合金加入100mL 5.0mol•L﹣1NaOH溶液中,充分反应后收集到6.72L气体(标准状况),过滤得到溶液X.下列说法正确的是( )
A.产生气体的质量为0.3g
B.合金中镁与铝的物质的量之比为1:2
C.溶液X中剩余NaOH的物质的量为0.2 mol
D.向溶液X中通入足量C02,过滤,将沉淀充分灼烧得固体15.6 g
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高一下6月月考理科化学试卷(解析版) 题型:填空题
原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置.
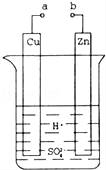
(1)a和b不连接时,烧杯中发生反应的离子方程式是
(2)a和b用导线连接,Cu极为原电池 极(填“正”或“负”),电极反应式是;Zn极发生 (填“氧化”或“还原”)反应,溶液中H+移向 (填“Cu”或“Zn”)极.
(3)a和b用导线连接,若Zn片质量减轻了6.5g,则另一极上理论上产生气体 L(标况下).
(4)有同学向把Ba(OH)28H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行? (填“是”或“否”),理由是 .
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高一下6月月考理科化学试卷(解析版) 题型:选择题
进行一氯取代反应后,只能生成三种沸点不同的产物的烷烃是( )
A.(CH3)2CHCH2CH2CH3
B.(CH3)2CHCH3
C.(CH3)2CH﹣CH(CH3)2
D.(CH3)3CCH2CH3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高一下6月月考理科化学试卷(解析版) 题型:选择题
下列说法中正确的是( )
A. 石油的分馏和煤的干馏都是物理变化
B. 油脂、淀粉、纤维素都是高分子化合物
C. 酯类物质是形成水果香味的主要成分
D. 纤维素和淀粉互为同分异构体
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二下6月月考化学试卷(解析版) 题型:填空题
工业上有一种方法有效地开发利用CO2,是用CO2来生产燃料甲醇。为探究反应原理,进行如下实验,在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示。

(1)从反应开始到平衡,氢气的平均反应速率v(CO2)= ________mol/(L•min);
(2)氢气的转化率= ________;
(3)求此温度下该反应的平衡常数K=________;
(4)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是________
A.将H2O(g)从体系中分离出去
B.充入He(g),使体系压强增大
C.升高温度
D.再充入1mol CO2和3mol H2
(5)当反应达到平衡时,CO2的物质的量浓度为c1,然后向容器中再加入一定量CO2,待反应再一次达到平衡后,CO2的物质的量浓度为c2,则c1________ c2(填>、<、=)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二下期末化学试卷(解析版) 题型:实验题
工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质.某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解).
(1)实验原理:①Al4C3与硫酸反应可生成CH4;②AlN溶于强酸产生铵盐,溶于强碱生成氨气.写出Al4C3与硫酸反应的化学方程 .
(2)实验装置(如图所示):
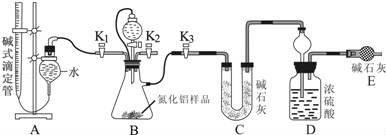
(3)实验过程:
①连接实验装置,检验装置的气密性.称得D装置的质量为yg,滴定管的读数为amL;
②称取xgAlN样品置于装置B瓶中;塞好胶塞,关闭活塞K2、K3,打开活塞K1,通过分液漏斗加入稀硫酸,与装置B瓶内物质充分反应;
③待反应进行完全后,关闭活塞K1,打开活塞K3,通过分液漏斗加入过量NaOH,与装置B瓶内物质充分反应;
④ (填入该步应进行的操作);
⑤记录滴定管的读数为bmL,称得D装置的质量为zg.
(4)数据分析:(已知:该实验条件下的气体摩尔体积为Vm L•mol﹣1)
①Al4C3的质量分数为 ;
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积 (填“偏大”、“偏小”或“无影响”下同).若分液漏斗和吸滤瓶间没有用橡胶管连通,则所测气体的体积 ;
③AlN的质量分数为 .
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北武汉新洲一中、黄陂一中联考高二下期末化学试卷(解析版) 题型:选择题
下列实验正确的是( )
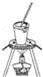
A. 蒸发、浓缩
B. 检查装置气密性
C. 碳酸氢钠受热分解
D. 分离沸点不同且互溶的液体混合体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com