
| A、催化剂可以缩短可逆反应达到平衡的时间,但是不能改变化学平衡状态 |
| B、如果改变影响平衡的一个条件,平衡就会朝着减弱这种改变的方向移动 |
| C、对于合成氨工业,在合成氨的反应中,温度越高,越有利于氨的合成 |
| D、化学平衡常数、平衡转化率均可用于说明化学反应的限度 |


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
| A、NaHCO3溶液与醋酸:CO32-+2CH3COOH=2CH3COO-+H2O+CO2↑ |
| B、硝酸银溶液与铜:Cu+Ag+=Cu2++Ag |
| C、将足量的铁粉投入稀硝酸中:Fe+NO3-+4 H+=Fe3++NO↑+2H2O |
| D、用醋酸除水垢:2CH3COOH+CaCO3=Ca2++2CH3COO-+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(B) |
| c(C) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、正反应速率加大,逆反应速率变小,平衡正向移动 |
| B、正反应速率变小,逆反应速率加大,平衡逆向移动 |
| C、正反应速率和逆反应速率都变小,平衡正向移动 |
| D、正反应速率和逆反应速率都变小,平衡逆向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
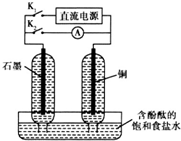 某兴趣小组设计如图微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表A指针偏转.下列有关描述正确的是( )
某兴趣小组设计如图微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表A指针偏转.下列有关描述正确的是( )| A、断开K2,闭合K1时,铜电极为阳极 |
| B、断开K2,闭合K1时,石墨电极附近溶液变红 |
| C、断开K1,闭合K2时,铜电极发生还原反应 |
| D、断开K1,闭合K2时,石墨电极作正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、易溶与难溶固体混合物用溶解过滤方法提纯 |
| B、沸点不同的互溶液体可用蒸馏分离 |
| C、用酒精可以从碘水中萃取碘 |
| D、汽油和水的混合物可以用分液漏斗分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(m+2.28)g |
| B、(m+2.04)g |
| C、(m+3.32)g |
| D、(m+4.34)g |
查看答案和解析>>
科目:高中化学 来源: 题型:
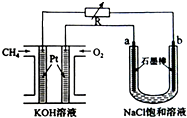 新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组用甲烷燃料电池作为电源,进行饱和氯化钠溶液电解实验,如图所示:
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组用甲烷燃料电池作为电源,进行饱和氯化钠溶液电解实验,如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com