
【题目】混合溶液中离子浓度大小比较(一般情况弱电解质的电离程度约为百分之一,而盐类水解程度约为千分之一)
(1)等物质的量的NH3·H2O和NH4Cl的混合溶液中存在的水解平衡是____,存在的电离平衡是____(不写水的电离平衡),由于NH3·H2O的电离程度_____NH4Cl的水解程度,故溶液显____性。溶液中离子浓度大小关系是_________。
(2)等物质的量的CH3COOH和CH3COONa的混合溶液中存在的水解平衡是____,存在的电离平衡是_______(不写水的电离平衡),由于CH3COOH的电离程度_____CH3COONa的水解程度,故溶液显____性。溶液中离子浓度大小关系是_________。
(3)等物质的量的HCN和NaCN的混合溶液中存在的水解平衡是___,存在的电离平衡是___(不写水的电离平衡),由于HCN的电离程度_____NaCN的水解程度,故溶液显____性。溶液中离子浓度大小关系是____。
【答案】NH4++H2O![]() NH3·H2O+H+ NH3·H2O
NH3·H2O+H+ NH3·H2O![]() NH4++ OH- > 碱 c(NH4+)>c(Cl-)>c(OH-)>c(H+) CH3COO-+H2O
NH4++ OH- > 碱 c(NH4+)>c(Cl-)>c(OH-)>c(H+) CH3COO-+H2O![]() CH3COOH+OH- CH3COOH
CH3COOH+OH- CH3COOH![]() CH3COO-+H+ > 酸 c(CH3COO-)>c(Na+)>c(H+)>c(OH-) CN-+H2O
CH3COO-+H+ > 酸 c(CH3COO-)>c(Na+)>c(H+)>c(OH-) CN-+H2O![]() HCN+OH- HCN
HCN+OH- HCN![]() CN-+H+ < 碱 c(Na+)>c(CN-)>c(OH-)>c(H+)
CN-+H+ < 碱 c(Na+)>c(CN-)>c(OH-)>c(H+)
【解析】
(1) NH4Cl是强酸弱碱盐,在溶液中NH4+发生水解反应消耗水电离产生的OH-,存在水解平衡;NH3·H2O是一元弱碱,在溶液中存在电离平衡,NH3·H2O的电离程度大于NH4+的水解程度,溶液显碱性;根据物料守恒及盐的水解规律比较离子浓度大小;
(2)CH3COONa是强碱弱酸盐,在溶液中CH3COO-发生水解反应消耗水电离产生的H+,存在水解平衡;CH3COOH是一元弱酸,在溶液中存在电离平衡。CH3COOH的电离程度大于CH3COO-的水解程度,溶液显酸性;根据物料守恒、盐的水解比较离子浓度大小;
(3)NaCN是强碱弱酸盐,在溶液中CN-发生水解反应消耗水电离产生的H+,存在水解平衡;HCN是一元弱酸,在溶液中存在电离平衡。HCN的电离程度小于CN-的水解程度,溶液显碱性;根据物料守恒、盐的水解比较离子浓度大小。
(1)NH4Cl是强酸弱碱盐,在溶液中NH4+发生水解反应:NH4++H2O![]() NH3·H2O+H+,水解产生H+使溶液显酸性;NH3·H2O是一元弱碱,在溶液中存在电离平衡,NH3·H2O
NH3·H2O+H+,水解产生H+使溶液显酸性;NH3·H2O是一元弱碱,在溶液中存在电离平衡,NH3·H2O![]() NH4++ OH-,电离产生OH-使溶液显碱性,等浓度的NH4Cl、NH3·H2O混合,由于NH3·H2O的电离程度大于NH4+的水解程度,所以溶液中c(OH-)>c(H+),溶液显碱性。根据物料守恒可知c(NH4+)>c(Cl-);盐电离产生的离子浓度大于弱电解质产生的离子浓度,所以c(Cl-)>c(OH-),故溶液中离子浓度关系为:c(NH4+)>c(Cl-)>c(OH-)>c(H+);
NH4++ OH-,电离产生OH-使溶液显碱性,等浓度的NH4Cl、NH3·H2O混合,由于NH3·H2O的电离程度大于NH4+的水解程度,所以溶液中c(OH-)>c(H+),溶液显碱性。根据物料守恒可知c(NH4+)>c(Cl-);盐电离产生的离子浓度大于弱电解质产生的离子浓度,所以c(Cl-)>c(OH-),故溶液中离子浓度关系为:c(NH4+)>c(Cl-)>c(OH-)>c(H+);
(2)CH3COONa是强碱弱酸盐,在溶液中CH3COO-发生水解反应:CH3COO-+H2O![]() CH3COOH+OH-,水解产生OH-使溶液显碱性;CH3COOH是一元弱酸,在溶液中存在电离平衡:CH3COOH
CH3COOH+OH-,水解产生OH-使溶液显碱性;CH3COOH是一元弱酸,在溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,电离产生H+使溶液显酸性,等浓度的CH3COOH和CH3COONa的混合,由于CH3COOH的电离程度大于CH3COO-的水解程度,最终溶液显酸性,c(H+)>c(OH-);根据物料守恒可知c(CH3COO-)>c(Na+);盐电离产生的离子浓度大于弱电解质电离产生的离子浓度,所以c(Na+)>c(H+)。故该盐的溶液中离子浓度关系为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
CH3COO-+H+,电离产生H+使溶液显酸性,等浓度的CH3COOH和CH3COONa的混合,由于CH3COOH的电离程度大于CH3COO-的水解程度,最终溶液显酸性,c(H+)>c(OH-);根据物料守恒可知c(CH3COO-)>c(Na+);盐电离产生的离子浓度大于弱电解质电离产生的离子浓度,所以c(Na+)>c(H+)。故该盐的溶液中离子浓度关系为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
(3)NaCN是强碱弱酸盐,在溶液中CN-发生水解反应:CN-+H2O![]() HCN+OH-,水解产生OH-使溶液显碱性;HCN是一元弱酸,在溶液中存在电离平衡:HCN
HCN+OH-,水解产生OH-使溶液显碱性;HCN是一元弱酸,在溶液中存在电离平衡:HCN![]() CN-+ H+,HCN电离产生H+,使溶液显酸性。等浓度的NaCN、HCN混合,由于HCN的电离程度小于CN-的水解程度,c(OH-)>c(H+),所以溶液显碱性;根据物料守恒可知c(Na+)>c(CN-);盐电离产生的离子浓度大于弱电解质电离产生的离子浓度,所以c(CN-)>c(OH-)。故该盐的溶液中离子浓度关系为:c(Na+)>c(CN-)>c(OH-)>c(H+)。
CN-+ H+,HCN电离产生H+,使溶液显酸性。等浓度的NaCN、HCN混合,由于HCN的电离程度小于CN-的水解程度,c(OH-)>c(H+),所以溶液显碱性;根据物料守恒可知c(Na+)>c(CN-);盐电离产生的离子浓度大于弱电解质电离产生的离子浓度,所以c(CN-)>c(OH-)。故该盐的溶液中离子浓度关系为:c(Na+)>c(CN-)>c(OH-)>c(H+)。


科目:高中化学 来源: 题型:
【题目】煤和石油等化石燃料对促进经济社会发展起到了重要的作用,这些燃料合理的综合利用是当前节能减排的要求。请回答下列问题:
(1)石油分馏是石油炼制的重要环节,这种操作是在_______(填设备名称)内完成的。工业上通常使用的分馏石油的方法有常压分馏和_____,分馏的目的是___________。
(2)石油不仅是重要的燃料,还是重要的化工原料的来源,如利用石油生产乙烯。为了使石油分馏产物进一步生成更多的乙烯、丙烯等短链烃而采取______措施。
(3)目前石油资源逐渐匮乏,人们把目光聚集到储量相对丰富的煤上。目前煤综合利用的主要方法是________________、________和煤的气化,煤气化涉及的化学方程式有:C+O2![]() CO2 2C+O2
CO2 2C+O2![]() 2CO _____________(写出第三个化学方程式)。
2CO _____________(写出第三个化学方程式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铁铵[aFe2(SO4)3·b(NH4)2SO4·cH2O]广泛用于城镇生活饮用水、工业循环水的净化处理等。某化工厂以硫酸亚铁(含少量硝酸钙)和硫酸铵为原料,设计了如下工艺流程制取硫酸铁铵。
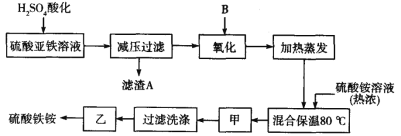
请回答下列问题:
(1)硫酸亚铁溶液加 H2SO4 酸化的主要目的是____________,滤渣 A的主要成分是______________。
(2)下列物质中最适合的氧化剂 B 是____________。
a.NaClO b.H2O2 c.KMnO4 d.K2Cr2O7
(3)操作甲、乙的名称分别是:甲_____________,乙_____________。
(4)上述流程中,有一处不严密,请指出并修改_____________。
(5)检验硫酸铁铵中NH4+的方法是_____________。
(6)称取 14.00 g 样品,将其溶于水配制成 100 mL 溶液,并分成两等份,向其中一份 中加入足量 NaOH 溶液,过滤洗涤得到 2.14 g 沉淀;向另一份溶液中加入 0.05 mol Ba(NO3)2 溶液,恰好完全反应。则该硫酸铁铵的化学式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.11g的D218O中含有的中子数为5NA
B.1 LpH=2的H2SO4溶液中H+的数目为0. 02NA
C.将0.1mol Cl2通入足量FeI2溶液中,转移电子的数目为0.2NA
D.标准状况下,4. 48 L甲烷与足量Cl2完全反应生成CH3Cl的分子数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年国际非政府组织“全球碳计划”12月4日发布报告:研究显示,全球二氧化碳排放量增速趋 缓。CO2的综合利用是解决温室问题的有效途径。
(1)一种途径是将CO2转化成有机物实现碳循环。如:
![]()
![]()
![]() △H3=____
△H3=____
(2)CO2甲烷化反应是由法国化学家Paul Sabatier提出的,因此,该反应又叫Sabatier反应。CO2催化氢化 制甲烷的研究过程如下:
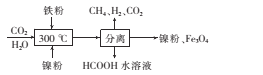
①上述过程中,产生H2反应的化学方程式为____
②HCOOH是CO2转化为CH4的中间体:CO2![]() HCOOH
HCOOH![]() CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,当增加镍粉用量时,CO2镍催化氢化制甲烷的两步反应中反应速率增加较大的一步是_____填“I”或“Ⅱ”)。
CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,当增加镍粉用量时,CO2镍催化氢化制甲烷的两步反应中反应速率增加较大的一步是_____填“I”或“Ⅱ”)。
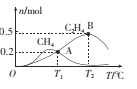
(3)CO2经催化加氢可以生成低碳烃,主要有两个竞争反应:
反应I: ![]()
反应Ⅱ:![]()
在1 L恒容密闭容器中充人1 mol CO2和4 mol H2,测得平衡时有关物质的物质的量随温度变化如图所示。T1℃时,CO2的转化率为____。T1℃时,反应I的平衡常数K= ___。
(4)已知CO2催化加氢合成乙醇的反应原理为![]() ,m代表起始时的投料比,即
,m代表起始时的投料比,即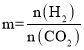
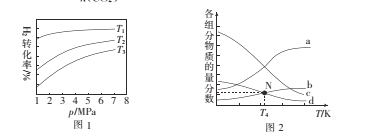
①图1中投料比相同,温度T3>T2>T1,则△H ______(填“>”或“<”)0。
②m=3时,该反应达到平衡状态后p(总)=20a MPa,恒压条件下各物质的物质的量分数与温度的关系如图2。则曲线b代表的物质为 ___(填化学式),T4温度时,反应达到平衡时物质d的分压p(d)=______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】思维辨析:
(1) 互为同分异构体。_________
互为同分异构体。_________
(2)烯烃分子中所有原子都在同一平面上_________
(3)既可以用溴水鉴别甲烷和乙烯,又可以用溴水除去甲烷中的乙烯。_________
(4)煤中含有芳香烃,可以通过干馏的方法得到芳香烃。_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鸡没有汗腺,只能依赖“喘息”调节体温。鸡过度地呼出CO2,使下列平衡向左移动,导致蛋壳变薄,使农场主和超市经营者蒙受经济损失。CO2(g)![]() CO2(aq),CO2(aq) + H2O
CO2(aq),CO2(aq) + H2O![]() H2CO3(aq);H2CO3(aq)
H2CO3(aq);H2CO3(aq)![]() H+(aq) + HCO3-(aq);HCO3-(aq)
H+(aq) + HCO3-(aq);HCO3-(aq) ![]() H+(aq) + CO32-(aq);Ca2+(aq) + CO32-(aq)
H+(aq) + CO32-(aq);Ca2+(aq) + CO32-(aq) ![]() CaCO3(s)(蛋壳)。澳大利亚学者研究发现,夏季给鸡喂食下列某种饮料会使蛋壳变厚,这种饮料可能是( )
CaCO3(s)(蛋壳)。澳大利亚学者研究发现,夏季给鸡喂食下列某种饮料会使蛋壳变厚,这种饮料可能是( )
A.淡盐水B.碳酸水
C.蔗糖D.澄清石灰水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的结构决定性质。回答下列有关问题:
(1)BF3的空间构型为______。SO32-中心原子的杂化类型是______。
(2)H2S的沸点比H2O2的沸点______![]() 选填“高”或“低”
选填“高”或“低”![]() ;氮化铝、氮化硼、氮化镓三种晶体的结构与金刚石类似,其中熔点最高的是______。
;氮化铝、氮化硼、氮化镓三种晶体的结构与金刚石类似,其中熔点最高的是______。
(3)从分子结构的角度分析“白磷不溶于水,易溶于CS2”的原因______。
(4)CuCl难溶于水但易溶于氨水,其原因是______;此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为______。
(5)已知CaF2晶胞结构如图所示,晶体密度为![]() g/cm3,则晶胞的边长是______cm。(NA表示阿伏加德罗常数,用含
g/cm3,则晶胞的边长是______cm。(NA表示阿伏加德罗常数,用含![]() 、NA的代数式表达)
、NA的代数式表达)

(6)一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心、Au原子处于顶点位置,该晶体中原子之间的作用力是______;该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com