
 N2与H2反应生成NH3的过程中能量变化曲线如图所示.若在一个固定容积的密闭容器中充入1mol N2和3mol H2使反应N2(g)+3H2(g)?2NH3(g)达到平衡,测得反应放出热量为Q1kJ.
N2与H2反应生成NH3的过程中能量变化曲线如图所示.若在一个固定容积的密闭容器中充入1mol N2和3mol H2使反应N2(g)+3H2(g)?2NH3(g)达到平衡,测得反应放出热量为Q1kJ.分析 (1)N2与H2反应生成NH3的反应为可逆反应,反应为不能完全转化为生成物;
(2)加催化剂降低反应的活化能;
(3)根据反应的热量之比等于物质的量之比求出参加反应的氢气的物质的量,再求出转化率;
(4)若通入2mol N2和6mol H2,则初始反应物的物质的量增大了一倍,由于压强增大平衡正向移动,所以反应的热量增大.
解答 解:(1)由图可知反应的热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=508-600=-92kJ•mol-1,N2与H2反应生成NH3的反应为可逆反应,反应为不能完全转化为生成物,即1mol N2和3mol H2不能完全反应生成1molNH3,则反应放出的热量值Q1<92;
故答案为:<;
(2)加催化剂降低反应的活化能,所以图中b曲线代表加入了催化剂;
故答案为:加催化剂;
(3)设转化的氢气为xmol,
N2(g)+3H2(g)=2NH3(g)△H=-92kJ•mol-1
3mol 92kJ
xmol Q1kJ
则x=$\frac{3{Q}_{1}}{92}$ mol
所以 达平衡时H2的转化率为$\frac{\frac{3{Q}_{1}}{92}mol}{3mol}$=$\frac{{Q}_{1}}{92}$;
故答案为:$\frac{{Q}_{1}}{92}$;
(4)向密闭容器中通入1mol N2和3mol H2,不可能完全转化,所以达到平衡时放出热量Q1kJ;另一容积相同的密闭容器中通入2mol N2和6mol H2,达到平衡时原平衡相同,则放出热量应该是2QkJ,通入2mol N2和6mol H2的压强比通入1mol N2和3mol H2的大了,平衡还会向正向移动,放出的热量还会增大,即Q2>2Q1,
故答案为:Q2>2Q1.
点评 本题考查化学反应中的能量变化图、反应热的计算,题目难度中等,注意书写热化学方程式的注意事项以及反应热的计算方法.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 火星大气中氮气的体积分数小于地球空气中氮气的体积分数 | |
| B. | 火星大气中二氧化碳的体积分数小于地球空气中二氧化碳的体积分数 | |
| C. | 火星大气中氧气的体积分数大于地球空气中氧气的体积分数 | |
| D. | 火星大气中有稀有气体,地球空气中没有 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
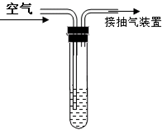 二氧化硫是大气污染物之一.我国的空气质量标准中对空气中二氧化硫的最高浓度(单位体积的空气中所含二氧化硫的质量)限值如下表所示:
二氧化硫是大气污染物之一.我国的空气质量标准中对空气中二氧化硫的最高浓度(单位体积的空气中所含二氧化硫的质量)限值如下表所示:| 级别 | 一级指标 | 二级指标 | 三级指标 |
| 浓度限值(mg/m3) | 0.15 | 0.50 | 0.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
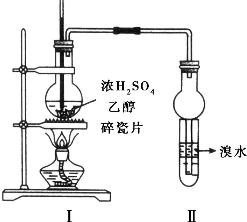 实验室制取乙烯的装置如图所示,试回答:
实验室制取乙烯的装置如图所示,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:3 | B. | 3:2:1 | C. | 1:1:1 | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三上学期月考三化学试卷(解析版) 题型:选择题
按照冶金工业的分类,下列合金属于黑色金属材料的是( )
A.锰钢 B.青铜 C.铝锂合金 D.镧镍储氢合金
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com