
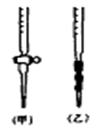
| A.用酸式滴定管取稀H2SO425.00mL,注入锥形瓶中,加入指示剂。 |
| B.用待测定的溶液润洗酸式滴定管 |
| C.用蒸馏水洗干净滴定管 |
| D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2—3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下 |


科目:高中化学 来源:不详 题型:单选题
| A.4 | B.1 | C.10 | D.3.3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.01mol·L-1CH3COONa溶液 | B.0.01mol·L-1NaHCO3溶液 |
| C.0.01mol·L-1NH4Cl溶液 | D.0.05mol·L-1CH3COONH4溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.①②④ | C.②③④ | D.①②③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.稀HCl和稀NaOH |
| B.1.0 mol·L-1 HCl和1.0 mol·L –1 NaOH |
| C.500 mL 2.0 mol·L-1 HCl和500 mL2.0 mol·L –1 NaOH |
| D.500 mL 2.0 mol·L-1 H2SO4和500 mL 2.0 mol·L-1 Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.pH=10的氨水稀释100倍 |
| B.pH=4的醋酸和pH=10的NaOH等体积混合 |
| C.pH=8的NaOH溶液与pH=8的Ba(OH)2等体积混合 |
| D.pH=11的NaOH溶液与pH=5的盐酸等体积混合 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com