
【题目】下列化合物不能用相应元素的单质直接化合而成的是( )
A. FeSB. Cu2SC. NO2D. SO2
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】世界能源消费的90%以上依靠化学技术。回答下列问题:
(1)质子交换膜燃料电池中作为燃料的H2通常来自水煤气。
已知:C(s)+![]() O2(g)=CO(g) △H1=-110.35kJ·mol-1
O2(g)=CO(g) △H1=-110.35kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1
H2O(1)=H2O(g) △H3=+44.0kJ·mol-1
则反应C(s)+H2O(g)![]() CO(g)+H2(g) △H4=___________。
CO(g)+H2(g) △H4=___________。
某实验小组在实验室模拟反应C(s)+H2O(g)![]() CO(g)+H2(g),其平衡常数表达式为K=___________。一定温度下,在2L盛有足量炭粉的恒容密闭容器中通入0.8molH2O,6min时生成0.7gH2。则6min内以CO表示的平均反应速率为___________(保留3位有效数字)。
CO(g)+H2(g),其平衡常数表达式为K=___________。一定温度下,在2L盛有足量炭粉的恒容密闭容器中通入0.8molH2O,6min时生成0.7gH2。则6min内以CO表示的平均反应速率为___________(保留3位有效数字)。
(2)燃料气(主要含N2和H2,还含有少量其他杂质)中的CO会使电极催化剂中毒,使用CuO/CeO2催化剂可使CO优先氧化而脱除。CeO2可由草酸铈[Ce(C2O4)3]灼烧制得,反应的化学方程式为___________。在CuO/CeO2催化剂中加入不同的酸(HIO3或H3PO4),测得燃料气中CO优先氧化的转化率随温度的变化如下图所示。
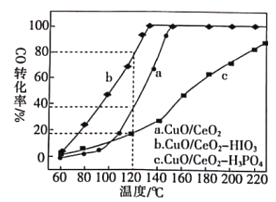
加入H3PO4___________(填“促进”或“抑制”)CuO/CeO2的催化。温度为120℃,催化剂为CuO/CeO2-HIO3时,若燃料气流速为1800mL·min-1,CO的体积分数为0.68%,则反应0.5h后CO的体积为___mL。
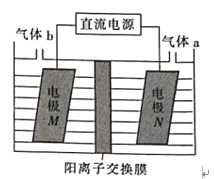
(3)LiOH是制备锂离子电池正极材料的重要原料,利用LiCl溶液电解制备得LiOH的装置如下图,LiOH在___________(填“M极”或“N极”)制得,N极产生的气体a通入淀粉KI溶液溶液变蓝,持续一段时间后,蓝色可逐渐褪去。据此写出N极的电极反应式:__________,蓝色逐渐褪去是因为溶液中逐渐生成HIO3,写出此反应的化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由反应物 X 分别转化为 Y 和 Z 的能量变化如图所示。下列说法正确的是( )
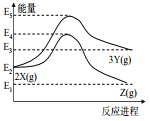
A.由 X→Z 反应的 ΔH<0 B.由 X→Y 反应的 ΔH=E5-E2
C.增大压强有利于提高 Y 的产率 D.升高温度有利于提高 Z 的产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程.反应过程的示意图如下:
下列说法不正确的是

A. CO和O生成CO2是放热反应。
B. 在该过程中,CO分子中碳氧键没有断裂成C和O。
C. 在该过程中,O与CO中C结合形成共价键。
D. 状态Ⅰ→状态Ⅲ表示CO与O2反应的过程。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关阿伏加德罗常数(NA)的说法错误的是( )
A. 32gO2所含的原子数目为NA
B. 0.5molH2O含有的原子数目为1.5NA
C. 1molH2O含有的H2O分子数目为NA
D. 0.5NA个CO2的物质的量是0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗铜中一般含有锌、铁、银、金等杂质.在如图3所示装置中,甲池的总反应方程式为:C2H5OH+3O2+4KOH=2K2CO3+5H2O 接通电路一段时间后,纯Cu电极质量增加了6.4 g。在此过程中,下列说法正确的是
A. 电子流向A→D→C→B
B. 乙池硫酸铜溶液的浓度不变
C. 甲池氧气消耗2.24 L
D. 甲池负极反应式为C2H5OH-12e﹣+16OH﹣=2CO32﹣+11H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硫酸工业中,通过下列反应使SO2转化为SO3:2SO2+O2![]() 2SO3 ΔH< 0,已知常压下平衡混合气体中SO3的体积分数为91%。试回答:
2SO3 ΔH< 0,已知常压下平衡混合气体中SO3的体积分数为91%。试回答:
(1)在生产中常用过量的空气,是为了________________________________;
(2)加热到400 ℃~500 ℃,是由于______________________________________;
(3)压强采用________,原因是__________________________________________________;
(4)常用浓H2SO4来吸收SO3而不用水,是因为__________________________________________;
(5)尾气中的SO2必须回收,是为了_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方法能达到实验目的的是
A.用K2CO3溶液除去NaCl溶液中的CaCl2
B.用氢氧化钠溶液鉴别硫酸铝和硫酸镁两种无色溶液
C.用澄清石灰水鉴别碳酸氢钠和碳酸钠两种溶液
D.用加热的方法除去碳酸氢钠固体中少量的碳酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧。
(1)由上述实验现象所得出的有关过氧化钠跟水反应的结论是:①有氧气生成;②____________。Na2O2跟水反应的化学方程式是____________。
(2)某研究性学习小组拟用如图所示装置(气密性良好)进行实验,以证明上述结论。用以验证第一条结论的实验方法是_________;用以验证第二条结论的实验方法是________。

(3)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学方程式为____。
(4)将Cl2制成漂白粉的主要目的是________(填字母)。
A.增强漂白能力和消毒作用
B.使它转化为较稳定物质,便于保存和运输
C.使它转化为较易溶于水的物质
D.提高氯的质量分数,有利于漂白、消毒
(5)将漂白粉溶于适量水中,呈白色浊状物,静置沉降。取少许上层清液,滴加碳酸钠溶液出现白色沉淀,发生反应的化学方程式为_________。
(6)瓶装漂白粉久置空气中会呈稀粥状而失去漂白作用。试用化学方程式表示漂白粉在空气中易失效的原因是①_____________;②__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com