
| A. | 第ⅠA族元素的金属性比第ⅡA族元素的金属性强 | |
| B. | 可以在元素周期表中金属与非金属元素分界线附近寻找合适的半导体材料 | |
| C. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增强 | |
| D. | 第三周期元素的离子半径从左到右逐渐减小 |
分析 A.Ca的金属性与Na的强;
B.金属与非金属元素分界线附近的元素,具有金属性与非金属性;
C.非金属性强,最高价氧化物对应的水化物的酸性强;
D.离子的电子层越多,离子半径越大;相同电子排布的离子,原子序数大的离子半径小.
解答 解:A.Ca的金属性与Na的强,应为同周期第ⅠA族元素的金属性比第ⅡA族元素的金属性强,故A错误;
B.金属与非金属元素分界线附近的元素,具有金属性与非金属性,则元素可作半导体材料,故B正确;
C.非金属性强,最高价氧化物对应的水化物的酸性强,则同周期非金属最高价氧化物对应的水化物的酸性从左到右依次增强,而低价氧化物的酸性无此规律,故C错误;
D.离子的电子层越多,离子半径越大;相同电子排布的离子,原子序数大的离子半径小,则第三周期元素的离子半径阴离子大于阳离子,且铝离子半径最小,故D错误;
故选B.
点评 本题考查元素周期表及元素周期律,为高频考点,把握元素的位置、性质及元素周期律为解答的关键,侧重性质比较的考查,注意选项C为解答的易错点,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 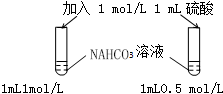 探究浓度对化学反应速率的影响 | B. | 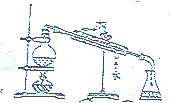 分离乙醇和乙酸的混合溶液 | ||
| C. | 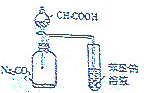 证明酸性:CH3COOH>H2CO3>苯酚 | D. | 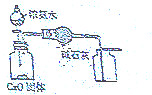 制取并且收集干燥纯净的NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分馏石油时,温度计的水银球必须插入液面以下 | |
| B. | 制备乙酸乙酯时,加料顺序为浓硫酸、乙醇、乙酸 | |
| C. | 配制银氨溶液时,将稀氨水慢慢滴加到稀硝酸银溶液中,产生白色沉淀后继续滴加,直至沉淀刚好溶解为止 | |
| D. | 实验室可用苯和溴水在Fe作催化剂的情况下制备溴苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定是共价键 | B. | 一定是离子键 | ||
| C. | 可能是共价键,也可能是离子键 | D. | 可能不形成化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
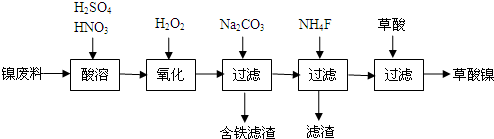
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
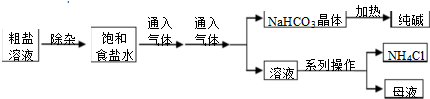
| A. | 对粗盐溶液除杂可依次加入NaOH、Na2CO3、BaCl2,再加入盐酸调节溶液pH | |
| B. | 饱和食盐水中先通入的气体为CO2 | |
| C. | 流程图中的系列操作中一定需要玻璃棒 | |
| D. | 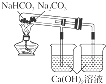 如图所示装置可以比较Na2CO3和NaHCO3晶体的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
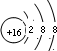 .X与Y形成的离子化合物的电子式为
.X与Y形成的离子化合物的电子式为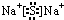 ,Z和Y的最高价氧化物对应的水化物反应的离子方程式为H++OH-=H2O.
,Z和Y的最高价氧化物对应的水化物反应的离子方程式为H++OH-=H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com