
【题目】某学习小组根据高中知识设计如下测定室内甲醛含量的装置(夹持装置已略)。
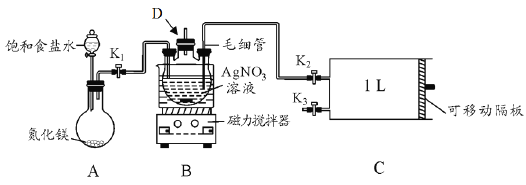
I.配制银氨溶液
(1)盛装AgNO3溶液的仪器D的名称_________。
(2)关闭K2和K3,打开K1和分液漏斗活塞,将饱和食盐水滴入到圆底烧瓶中,当观察到D中最初生成的白色沉淀恰好完全溶解时,关闭K1和分液漏斗活塞。请写出A装置中发生反应的化学方程式____;饱和食盐水的用途是_______。
(3)已知银氨溶液的成分是Ag(NH3)2OH,写出D中生成银氨溶液的化学方程式_________ 。
II.测定室内空气中甲醛含量
(4)用热水浴加热D,打开K3,将滑动隔板由最左端抽到最右端,吸入1L室内空气,关闭K3,后续操作是___________。共计进行上述操作十次。
(5)装置中毛细管的作用是_____________ 。
(6)已知甲醛被银氨溶液氧化的化学方程式为HCHO+4Ag(NH3)2OH=(NH4)2CO3+4Ag↓+6NH3↑+2H2O,测得共生成Ag 2.16mg。则空气中甲醛的含量为________mg L-1(空气中其它物质不与银氨溶液反应)。
(7)该设计装置存在一个明显的不足之处是_______。
【答案】三颈烧瓶 Mg3N2+6H2O=3Mg(OH)2+2NH3 降低氮化镁和水的反应速率 AgNO3+3NH3H2O=Ag(NH3)2OH+NH4NO3+2H2O或AgNO3+NH3H2O=AgOH↓+ NH4NO3、AgOH+2 NH3H2O= Ag(NH3)2OH+2H2O 打开K2,缓慢推动滑动隔板,将气体全部推出,再关闭K2 减小气体通入速率,使空气中甲醛气体被完全吸收 0.015或1.5×10-2 缺少尾气处理装置
【解析】
(1)依据仪器的构造写出仪器D的名称;
(2)饱和食盐水和氮化镁反应制备氨气,加入饱和食盐水的量控制减缓反应速率;
(3)A中饱和食盐水和氮化镁反应制取氨气,氨气通入硝酸银溶液中制备银氨溶液,三颈烧瓶中生成银氨溶液的化学方程式为AgNO3+3NH3H2O=Ag(NH3)2OH+NH4NO3+2H2O;
(4)后续操作是:打开K2,缓慢推动滑动隔板,将气体全部推出,再关闭K2,减少测定误差;
(5)装置中毛细管的作用是,减小气体的滴入速率使空气中甲醛气体被完全吸收;
(6)甲醛和银氨溶液加热反应生成银,结合甲醛被氧化为二氧化碳,氢氧化二氨合银被还原为银,甲醛中碳元素化合价0价变化为+4价,银+1价变化为0价,则根据氧化还原反应电子守恒计算可得,注意进行了10次操作;
(7)没有尾气处理装置,会造成污染。
(1)盛装AgNO3溶液的仪器D的名称是三颈烧瓶;故答案为:三颈烧瓶;
(2)A装置中饱和食盐水和氮化镁反应制备氨气,化学方程式为:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑,饱和食盐水的量控制减缓反应速率;故答案为:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑,饱和食盐水和氮化镁反应生成氨气并减缓生成氨气的速率;
(3)A中饱和食盐水和氮化镁反应制取氨气,氨气通入硝酸银溶液中制备银氨溶液,三颈烧瓶中生成银氨溶液的化学方程式为AgNO3+3NH3H2O=Ag(NH3)2OH+NH4NO3+2H2O,或AgNO3+NH3H2O=AgOH↓+ NH4NO3、AgOH+2 NH3H2O= Ag(NH3)2OH+2H2O;故答案为:AgNO3+3NH3H2O=Ag(NH3)2OH+NH4NO3+2H2O或AgNO3+NH3H2O=AgOH↓+ NH4NO3、AgOH+2 NH3H2O= Ag(NH3)2OH+2H2O;
(4)用热水浴加热三颈烧瓶,打开K3,将滑动隔板由最左端抽到最右端,吸入1L室内空气,关闭K3,后续操作是打开K2,缓慢推动滑动隔板,将气体全部推出,再关闭K2;故答案为:打开K2,缓慢推动滑动隔板,将气体全部推出,再关闭K2;
(5)装置中毛细管的作用是减小气体通入速率,使空气中甲醛气体被完全吸收;故答案为:减小气体通入速率,使空气中甲醛气体被完全吸收;
(6)甲醛和银氨溶液反应生成银和碳酸盐,根据甲醛被氧化为碳酸盐,氢氧化二氨合银被还原为单质银,甲醛中碳元素化合价由0价→+4价,银由+1价→0价,生成Ag 2.16mg,
根据电子守恒规律:设消耗甲醛的物质的量为x,则4x=![]() =2×10-5mol,x=5×10-6mol,因为实验进行了10次操作,所以测得1L空气中甲醛的含量为5×10-7mol,即为5×10-7×30×103mg/L=0.015mgL-1;故答案为:0.015或1.5×10-2;
=2×10-5mol,x=5×10-6mol,因为实验进行了10次操作,所以测得1L空气中甲醛的含量为5×10-7mol,即为5×10-7×30×103mg/L=0.015mgL-1;故答案为:0.015或1.5×10-2;
(7)此装置有一个明显的不足之处是:没有尾气处理装置,会造成空气污染;故答案为:没有尾气处理装置。


科目:高中化学 来源: 题型:
【题目】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体:
①D的化学式是________;
②在工业生产中,B气体的大量排放被雨水吸收后形成了________而污染了环境。
(2)若A在常温下为气体,C是红棕色的气体:
①A、C的化学式分别是:A________;C________。
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式_______________________________________________。该反应________(填“属于”或“不属于”)氧化还原反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)含碳物质的价值型转化,有利于“减碳”和可持续性发展,有着重要的研究价值。请回答下列问题:
(1)已知CO分子中化学键为C≡O。相关的化学键键能数据如下:
化学键 | H—O | C≡O | C=O | H—H |
E/(kJ·mol1) | 463 | 1075 | 803 | 436 |
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=___________kJ·mol1。下列有利于提高CO平衡转化率的措施有_______________(填标号)。
CO2(g)+H2(g) ΔH=___________kJ·mol1。下列有利于提高CO平衡转化率的措施有_______________(填标号)。
a.增大压强 b.降低温度
c.提高原料气中H2O的比例 d.使用高效催化剂
(2)用惰性电极电解KHCO3溶液,可将空气中的CO2转化为甲酸根(HCOO),然后进一步可以制得重要有机化工原料甲酸。CO2发生反应的电极反应式为________________,若电解过程中转移1 mol电子,阳极生成气体的体积(标准状况)为_________L。
(3)乙苯催化脱氢制取苯乙烯的反应为:![]() (g)+CO2(g)
(g)+CO2(g)![]()
![]() (g)+CO(g)+H2O(g),其反应历程如下:
(g)+CO(g)+H2O(g),其反应历程如下:
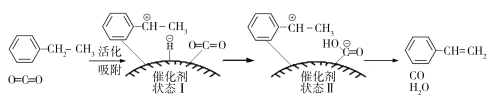
①由原料到状态Ⅰ____________能量(填“放出”或“吸收”)。
②一定温度下,向恒容密闭容器中充入2 mol乙苯和2 mol CO2,起始压强为p0,平衡时容器内气体总物质的量为5 mol,乙苯的转化率为_______,用平衡分压代替平衡浓度表示的化学平衡常数Kp=_______。[气体分压(p分)=气体总压(p总)×气体体积分数]
③乙苯平衡转化率与p(CO2)的关系如下图所示,请解释乙苯平衡转化率随着p(CO2)变化而变化的原因________________________________________________。
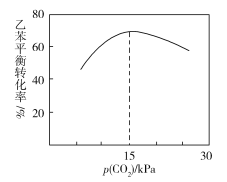
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在污水治理越来越引起人们重视。可以通过膜电池除去废水中的乙酸钠和对氯苯酚(![]() )同时利用此装置的电能在铁上镀铜,下列说法不正确的是( )
)同时利用此装置的电能在铁上镀铜,下列说法不正确的是( )
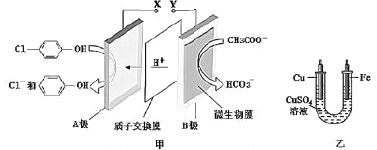
A.A极的电极反应式为![]() +e-=Cl-+
+e-=Cl-+![]()
B.当乙中铜电极质量减少6.4g,甲中A极区增加的日的个数为0.1NA
C.膜电池不适合在较高温度环境下工作
D.反应过程中乙中电解质溶液c(Cu2+)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1)N2(g)+3H2(g)2NH3(g) △H<0,研究表明金属催化剂可加速氨气的合成。下表为某温度下等质量的不同金属分别催化合成氨气时,氢气的初始速率(mmol min-1)。
催化剂 | Ru | Rh | Ni | Pt | Pd | Fe |
初始速率 | 7.9 | 4.0 | 3.0 | 2.2 | 1.8 | 0.5 |
①不同催化剂存在下,合成氨气反应的活化能最大的是_______ (填写催化剂的化学式)。
②某研究小组进一步探究催化剂对合成氨气的影响。将N2和H2以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NH3含量,如下图,从而确定温度对催化剂的影响。a点___ (填“是”或“不是”)对应温度下氨气平衡时的百分含量,说明其理由___。

(2)氨气的分解反应2NH3N2+3H2 △H<0,,在实际生产中往刚性容器中同时通入氨气和水蒸气,测得容器总压和氨气转化率随时间变化结果如图所示。
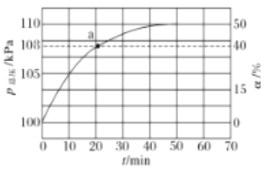
①平衡时,p(H2O)= ___kPa,平衡常数Kp=_____KPa2(Kp为以分压表示的平衡常数)。
②反应速率v=v正-v逆=K正p2(NH3)-K逆p(N2)p3(H2),k正、k逆分别为正、逆反应速率常数。计算a处的![]() =__。
=__。
(3)液氨中,2NH3(l)NH2-+NH4+,用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应______。
(4)在室温下用氨水吸收SO2。将含SO2的烟气通入该氨水中,当溶液显中性时,溶液中的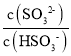 =____。(已知25℃,Kb(NH3H2O)=1.810-5;Ka1(H2SO3)=.310-2,Ka2(H2SO3)=6.210-8)
=____。(已知25℃,Kb(NH3H2O)=1.810-5;Ka1(H2SO3)=.310-2,Ka2(H2SO3)=6.210-8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A、B的分子式均为C11H12O5,均能发生如下变化。
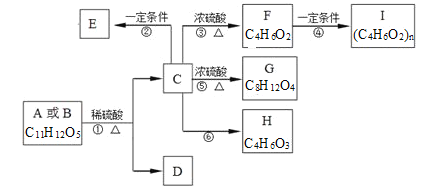
已知:①A、B、C、 D均能与NaHCO3反应;
②只有A、D能与FeCl3溶液发生显色反应,A苯环上的一溴代物只有两种;
③F能使溴水褪色且不含有甲基;
④H能发生银镜反应。
根据题意回答下列问题:
(1)反应③的反应类型是_____;反应⑥的条件是_______ 。
(2)写出F的结构简式___;D中含氧官能团的名称是_______。
(3)E是C的缩聚产物,写出反应②的化学方程式__________ 。
(4)下列关于A~I的说法中正确的是____ (选填编号)。
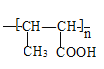
a.I的结构简式为
b.D在一定条件下也可以反应形成高聚物
c.G具有8元环状结构
d.等质量的A与B分别与足量NaOH溶液反应,消耗等量的NaOH
(5)写出B与足量NaOH溶液共热的化学方程式______。
(6) D的同分异构体有很多种,写出同时满足下列要求的其中一种同分异构体的结构简式______。
①能与FeCl3溶液发生显色反应;能发生银镜反应但不能水解;③苯环上的一卤代物只有2种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是病人输液用的葡萄糖(分子式为C6H12O6)注射液的标签上的部分内容。据标签所提供的信息,以下说法错误的是( )
5%葡萄糖注射液
500 mL
(性状)本品为无色或几乎为无色的透明液体
(规格)500 mL 25 g
(贮藏)密封保存
A. 该注射液中葡萄糖的质量分数是5%
B. 葡萄糖的摩尔质量为180 g·mol-1
C. 该注射液的密度约为1g·cm-3
D. 该注射液中葡萄糖的物质的量浓度约为0.014mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(![]() )。下列说法不正确的是
)。下列说法不正确的是
①![]()
![]()
②![]()
![]()
③![]()
![]()
④![]()
![]()
A. 反应①、②为反应③提供原料气
B. 反应③也是![]() 资源化利用的方法之一
资源化利用的方法之一
C. 反应![]() 的
的![]()
D. 反应![]() 的
的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金晶体的最小重复单元(也称晶胞)是面心立方体,即在立方体的8个顶点各有一个金原子,各个面的中心有一个金原子,每个金原子被相邻的晶胞共用。金原子的直径为dcm,用NA表示阿伏加德罗常数,M表示金的摩尔质量(单位:g·mol-1)。
(1)金晶体每个晶胞中含有________个金原子。
(2)欲计算一个晶胞的体积,除假定金原子是刚性小球外,还应假定_________。
(3)一个晶胞的体积为________cm3。
(4)金晶体的密度为________g·cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com