
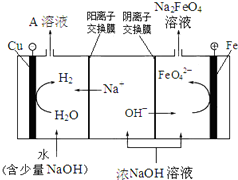
 高铁酸钠(Na2FeO4)是一种多功能、高效无毒的新型绿色水处理剂.
高铁酸钠(Na2FeO4)是一种多功能、高效无毒的新型绿色水处理剂.

科目:高中化学 来源: 题型:
| A、溶质从溶液中析出是得到晶体的三条途径之一 |
| B、区别晶体和非晶体最好的方法是观察是否有规则的几何外形 |
| C、水晶在不同方向上的硬度、导热性、导电性相同 |
| D、只有无色透明的固体才是晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、贮氯罐意外泄漏,应沿逆风方向疏散群众 |
| B、铝制餐具不宜长期存放酸性、碱性或咸的食物 |
| C、氢氧化铝可作胃酸的中和剂 |
| D、漂白粉能在空气中长期存放 |
查看答案和解析>>
科目:高中化学 来源: 题型:
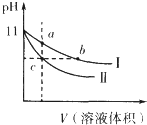 某温度下,相同pH值的氨水和氢氧化钠溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )
某温度下,相同pH值的氨水和氢氧化钠溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )| A、Ⅱ为氨水稀释时的pH值变化曲线 |
| B、a、b、c三点溶液的导电性:c>b=a |
| C、a、b、c三点溶液中水的电离程度:c=b>a |
| D、用相同浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸的体积:Vb=Vc |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△H>0,△S>0的反应任何条件都是非自发反应 |
| B、因N2(g)+3H2(g)?2NH3(g)△H=-d kJ/mol,故在某容器中投入1 mol N2与3 mol H2充分反应后,放出热量小于d kJ |
| C、一定温度下,在固定体积密闭容器中,发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0,当v正(SO2)=v正(SO3)时,说明该反应已达到平衡状态 |
| D、H2标准燃烧热△H=-285.8 kJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(g)△H=-571.6 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5×10-13mol/L |
| B、0.01 mol/L |
| C、1×10-7 mol/L |
| D、1×10-12mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Z为0.3mol/L |
| B、Y2为0.1mol/L |
| C、X2为0.2mol/L |
| D、Z为0.4mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com