
| A. | 将FeCl3固体放入水中搅拌 | |
| B. | 向FeCl3溶液中加入NaOH溶液 | |
| C. | 加热FeCl3溶液 | |
| D. | 向沸水中滴加饱和FeCl3溶液,并加热至红褐色 |
科目:高中化学 来源: 题型:选择题
| A. | C60是一种新型的化合物 | B. | C60和石墨互为同素异形体 | ||
| C. | C60中是一种碳原子 | D. | C60的式量是120 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 摩尔是物质的量的单位 | |
| B. | 物质的量的符号是M | |
| C. | H2的摩尔质量是2g | |
| D. | NA表示阿伏加德罗常数,lmolCl2含有2NA个氯原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
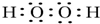 .W、X、Y 的离子半径由大到小的顺序为S2->O2->Al3+(用离子符号回答)
.W、X、Y 的离子半径由大到小的顺序为S2->O2->Al3+(用离子符号回答)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3(溶液):NaHCO3═Na++H++CO32- | |
| B. | NaHSO4(溶液):NaHSO4═Na++H++SO42- | |
| C. | (NH4)2SO4(溶液):(NH4)2SO4═(NH4)2++SO42- | |
| D. | CuCl2(溶液):CuCl2═Cu2++Cl2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁片与稀硫酸的反应 | B. | Ba(OH)2•8H2O与NH4Cl反应 | ||
| C. | 灼热的炭与CO2的反应 | D. | 甲烷在氧气中的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com