
| A. | 化学电池的反应本质是氧化还原反应 | |
| B. | 最早使用的化学电池是锌锰电池 | |
| C. | 最早使用的充电电池是铅蓄电池 | |
| D. | 二次电池的放电反应与充电反应可能是可逆反应 |
分析 A、原电池是在两极分别发生氧化和还原反应,外电路电子的定向移动;
B、最早使用的充电电池是铅蓄电池,而锌锰电池是一次性电池;
C、最早使用的充电电池是铅蓄电池;
D、可逆反应必须反应条件相同.
解答 解:A、原电池是在两极分别发生氧化和还原反应,外电路电子的定向移动,所以化学电池的反应本质是氧化还原反应,故A正确;
B、最早使用的充电电池是铅蓄电池,而锌锰电池是一次性电池,故B正确;
C、最早使用的充电电池是铅蓄电池,故C正确;
D、放电过程是原电池,是自发的氧化还原反应;而充电过程是电解池,是非自发的氧化还原反应,是用电流强迫电解质溶液在两极发生氧化还原反应,因为条件不一样,所以它们是不可逆的,故D错误;
故选D.
点评 本题考查了原电池和电能的有关知识,难度不大,明确充电电池的放电反应与充电反应不互为可逆反应.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:解答题
 .
. .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
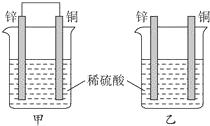
| A. | 两烧杯中溶液的pH值均增大 | B. | 产生气泡的速率甲比乙快 | ||
| C. | 两烧杯中铜片表面均无气泡产生 | D. | 甲中铜片是正极,乙中锌片是负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子键是阴、阳离子之间的相互吸引力 | |
| B. | 电能是一种使用最方便、污染最小的一次能源 | |
| C. | 由分子构成的物质中一定存在共价键 | |
| D. | 决定化学反应速率的主要因素是反应物体本身的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
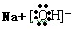 ,含有化学键的类型离子键、极性键;
,含有化学键的类型离子键、极性键; 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中只含离子键 | B. | 共价化合物中不含离子键 | ||
| C. | 离子化合物中不可能含共价键 | D. | 共价化合物中可能含离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com