




 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
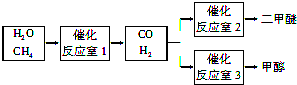
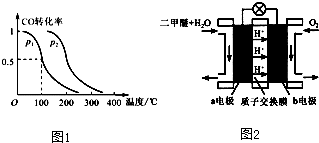
查看答案和解析>>
科目:高中化学 来源: 题型:
①过滤 ②NaOH ③BaCl2 ④盐酸 ⑤Na2CO3
当电解
(2)摩托罗拉公司研发了一种由甲醇(CH3OH)和氧气以及强碱作电解质溶液的新型手机电池。若放电过程中,甲醇完全氧化产生的CO2被碱充分吸收生成![]() 。则该电池反应的总离子方程式为________________________________________;甲醇在_____________极发生_____________反应。
。则该电池反应的总离子方程式为________________________________________;甲醇在_____________极发生_____________反应。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年重庆市三峡名校联盟高一下学期期中考试化学试卷(带解析) 题型:单选题
一种由甲醇(CH3OH)和氧气以及氢氧化钠做电解质溶液的新型电池,其两极的电极反应式为: 2CH3 OH+16OH-―12e-=2CO32-+12H2O , 6H2O+3O2+12e-=12OH-,关于此电池的推断正确的是( )
| A.通入氧气的一极是负极 |
| B.放电时,溶液中的OH-向正极移动 |
| C.反应中若有6mol电子发生转移,则有32g CH3 OH被还原 |
| D.该电池工作时甲醇一极附近溶液的pH降低 |
查看答案和解析>>
科目:高中化学 来源:2015届重庆市三峡名校联盟高一下学期期中考试化学试卷(解析版) 题型:选择题
一种由甲醇(CH3OH)和氧气以及氢氧化钠做电解质溶液的新型电池,其两极的电极反应式为: 2CH3 OH+16OH-―12e-=2CO32-+12H2O , 6H2O+3O2+12e-=12OH-,关于此电池的推断正确的是( )
A.通入氧气的一极是负极
B.放电时,溶液中的OH-向正极移动
C.反应中若有6mol电子发生转移,则有32g CH3 OH被还原
D.该电池工作时甲醇一极附近溶液的pH降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com