
【题目】对羟基扁桃酸是农药、药物、香料合成的重要中间体,它可由苯酚和乙醛酸在一定条件下反应制得:

下列说法不正确的是
A. 上述反应的原子利用率可达到100%
B. 在核磁共振氢谱中对羟基扁桃酸应该有6个吸收峰
C. 1mol对羟基扁桃酸与足量NaOH溶液反应,消耗3 mol NaOH
D. 可以用FeCl3溶液鉴别乙醛酸和苯酚
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】下列对文中描述内容的相关解释正确的是( )
选项 | 描述 | 解铎 |
A | 丹砂烧之成水银,积变又还成丹砂 | 两个反应互为可逆反应 |
B | 凡埏泥造瓦,掘地二尺余,择取无沙粘土而为之 | 其中“瓦”的主要成分为硅酸盐 |
C | 硝石(KNO3)如握盐雪不冰,强烧之,紫青烟起 | 产生“紫青烟”的原因为KNO3分解 |
D | 其法用浓酒精和槽入瓶,蒸令气上,用器承滴露 | 其中涉及的操作方法为蒸发浓缩 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示某化学反应过程中,生成物的量与时间的关系,图中a、b、c三条曲线不能反映下列哪种因素对生成物的量的影响( )

A. 不同的温度 B. 不同的pH值
C. 不同的底物浓度 D. 不同的酶浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成。
(1)Al的原子结构示意图为____________;Al与NaOH溶液反应的离子方程式为____________。
(2)30Si的原子的中子数为________________________。SiO2的晶体类型为_____________。
(3)Al3+与Yn-的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是___________________。
(4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是____________。
(5)经处理后的熔渣36.0 g(仅含Fe2O3、Al2O3、SiO2),加入足量稀盐酸,分离得到11.0 g固体;滤液中加入过量NaOH溶液,分离得到21.4 g固体;则此熔渣中Al2O3的质量分数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废镍催化剂中主要有Ni,还有Al、Fe、SiO2及其它不溶于酸、碱的杂质。现用废镍催化剂制备NiSO4·7H2O晶体,其流程如下图:

已知:Ksp[Fe(OH)3]=8.0×10-38,Ka sp[Fe(OH)2]=8.0×10-16,K[Al(OH)3]=3.2×10-34,Ksp[Ni(OH)2]=2.0×10-15,1g2=0.3,
回答下列问题
(1)“碱浸”的目的是______。
(2)“酸浸时发生的离子方程式为Fe+2H+=Fe2++H2↑、_______。
(3)“净化除杂需要先加入H2O2溶液,发生反应的离子方程式为______,然后调节PH=_______时,使杂质离子恰好完全沉淀(注:离子浓度小于或等于1×10-5mol/L时沉淀完全)
(4)“操作A为”______。
(5)Ni2+在强碱性溶液中还可被NaClO氧化为NiOOH,该反应离子方程式为______。
(6) NiOOH也可作为原电池的电极材料,若在碱性条件下形成燃料电池,负极通入N2H4气体,则负极的电极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①在BF3分子中,F—B—F的键角是________,B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4,BF![]() 的立体构型为________;
的立体构型为________;
②在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________。
(2)①Y2X2(C2H2)分子中Y原子轨道的杂化类型为______,1 mol Y2X2含有σ键的数目为______。
②元素Y(C)的一种氧化物与元素Z(N)的一种氧化物互为等电子体,元素Z的这种氧化物的分子式为________。
③化合物ZX3(NH3)的沸点比化合物YX4(CH4)的高,其主要原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钾可用于有机合成、制药等,它是一种白色立方结晶或粉末,易溶于水。实验室制备KI 的实验装置如下

实验步骤如下:
①在上图所示的C中加入 127g 研细的单质I2 和 195g 30%的 KOH 溶液,剧烈搅拌。
②I2完全反应后,打开弹簧夹向其中通入足量的 H2S。
③将装置 C 中所得溶液用稀 H2SO4酸化后,置于水浴上加热 10min。
④在装置 C 的溶液中加入 BaCO3 ,充分搅拌后,过滤、洗涤。
⑤将滤液用氢碘酸酸化,蒸发浓缩至表面出现结晶膜, 、 、洗涤、干燥。
⑥得产品 145g。
回答下列问题;
(1)步骤①将碘研细的目的是_____________________________________。
(2)装置A 中发生反应的离子方程式为_______________________________ ;装置 B 中的试剂是____________________,C装置的名称是_____________。
(3)装置 C 中I2与 KOH 反应产物之一是 KIO3 ,该反应的化学方程式为_______________。
(4)步骤④的目的是___________________________________ 。
(5)补充完整步骤⑤ __________________、_______________。
(6)本次实验产率为__________________ (保留四位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度时,在2 L容器中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。由此分析,该反应的化学方程_____________________________________;从反应开始至2 min,Z的反应速率为_____ mol·L-1·min-1。

(2)若上述反应的△H<0,下列有关该反应速率的叙述,正确的是_________。
A.升高温度和增大压强均可以增大活化分子百分数,加快反应速率
B.使用催化剂可以使反应的活化能降低,加快反应速率
C.活化分子间所发生的碰撞为有效碰撞
D.降低温度,v正、v逆均减小且v正减小的倍数小于v逆减小的倍数
(3)在一密闭容器中发生反应N2(g)+3H2(g)![]() 2NH3(g)△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。 t1、t3、t4时刻分别改变的一个条件是:
2NH3(g)△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。 t1、t3、t4时刻分别改变的一个条件是:
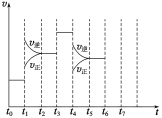
A.增大压强 B.减小压强 C.升高温度 D.降低温度 E.加催化剂 F.充入氦气
t1时刻________;t3时刻________;t4时刻________(填字母)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com