
| A. | Na+ K+ SO42- HCO3- | B. | Cu2+ K+ SO42- NO3- | ||
| C. | Na+ K+Cl- NO3- | D. | Fe3+ K+ SO42- Cl- |
分析 溶液无色时可排除Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,酸性溶液中存在大量氢离子,
A.碳酸氢根离子与氢离子反应;
B.铜离子为有色离子,不满足溶液无色的条件;
C.四种离子之间不反应,都是无色离子,都不与氢离子反应;
D.铁离子为有色离子,不满足溶液无色的条件.
解答 解:A.H+、HCO3-离子间能结合成二氧化碳和水,在溶液中不能共存,故A错误;
B.铜离子为蓝色溶液,不符合溶液无色的条件,故B错误;
C.四种离子间在酸性溶液中不能结合成沉淀、气体或水,能大量共存,且不存在有色离子,能形成无色透明溶液,故C正确;
D.铁离子为黄色溶液,不符合题意,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间等;应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -74.8kJ.mol-1 | B. | +74.8kJ.mol-1 | C. | -149.6kJ.mol-1 | D. | +149.6kJ.mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某温度时,在一个5L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.试根据图中数据,填写下列空白:
某温度时,在一个5L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.试根据图中数据,填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
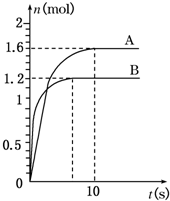
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应③中Br2 是氧化剂,溴元素被氧化 | |
| B. | 氧化性强弱顺序为:MnO4->Cl2>Fe3+>Br2 | |
| C. | 反应①中,被氧化的HCl占参加反应的HCl的5/8 | |
| D. | 溶液中可发生反应:2Fe3++2Cl-=2Fe2++Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铜溶液与铁粉反应:Cu2++Fe═Fe2++Cu | |
| B. | 碳酸钙与盐酸反应:CaCO3+2H+═H2O+CO2↑ | |
| C. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO${\;}_{4}^{2-}$═BaSO4↓ | |
| D. | 稀硫酸与铁粉反应:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为避免船体遭受腐蚀,在船舶的外壳装上若干锌块,称为牺牲阳极的阴极保护法 | |
| B. | 原电池工作时,电流的方向由正极→负载→负极→原电池中电解质溶液→正极 | |
| C. | 白铁(镀锌铁)镀层破损后,铁皮依然受到保护 | |
| D. | 在铁制品上镀铜时,铁制品作电镀池的阳极,铜盐为电镀液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com