
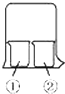
 使用如图所示装置进行化学小实验,请填写下列空白:
使用如图所示装置进行化学小实验,请填写下列空白:分析 (1)依据浓氨水具有挥发性,氨气为碱性气体解答;
(2)浓氨水以挥发,氨气与水反应生成一水合氨,与氯化铝反应生成氢氧化铝沉淀;
(3)浓硝酸、浓氨水易挥发,硝酸与氨气反应生成硝酸铵;
(4)无色一氧化氮不稳定,与氧气反应生成红棕色的二氧化氮.
解答 解:(1)浓氨水具有挥发性,挥发出的氨气为碱性气体,能够与水反应生成一水合氨,一水合氨电离生成氢氧根离子,能够使石蕊试纸变蓝,
故答案为:石蕊试纸变蓝;
(2)浓氨水以挥发,氨气与水反应生成一水合氨,与氯化铝反应生成氢氧化铝沉淀;
故答案为:①中有白色沉淀生成;
(3)浓硝酸、浓氨水易挥发,硝酸与氨气反应生成硝酸铵,所以会看到产生大量白烟;
故答案为:烧杯中有白烟生成;
(4)一氧化氮不稳定,与氧气反应生成红棕色的二氧化氮,化学方程式:2NO+O2=2NO2,故答案为:2NO+O2=2NO2.
点评 本题通过实验现象的描述考查了物质的性质,熟悉浓氨水、硝酸的性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
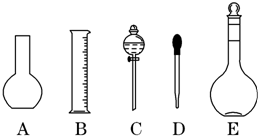 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-在水溶液中的水解方程式:HCO3-+H2O?H3O++CO32- | |
| B. | 用加热的方法可以除去KCl溶液中的Fe3+ | |
| C. | AlCl3溶液和NaAlO2溶液分别加热、蒸干,得到成分相同的固体Al(OH)3 | |
| D. | NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | IBr是双原子分子 | |
| B. | 在很多反应中IBr是氧化剂 | |
| C. | 和水反应时IBr既是氧化剂又是还原剂 | |
| D. | 和NaOH溶液反应生成NaBr和NaIO |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气是一种具有刺激性气味的无色气体 | |
| B. | 新制氯水可使蓝色石蕊试纸先变红后褪色 | |
| C. | 光照氯水有气泡逸出,该气体是Cl2 | |
| D. | 铁分别与氯气、盐酸反应时得到相同的氯化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol OH-中含有10NA个电子 | |
| B. | 46g的NO2气体中含有NA个NO2分子 | |
| C. | 1 L 1 mol/L的AlCl3溶液中含有NA个Al3+ | |
| D. | 常温常压下11.2 L的甲烷气体含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ③④ | C. | ②③ | D. | ①② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com