
| A. | Ⅰ和Ⅱ两途径最终达到平衡时,系统内混合气体的百分组成相同 | |
| B. | Ⅰ和Ⅱ两途径最终达到平衡时,系统内混合气体的百分组成不同 | |
| C. | 达到平衡时Ⅰ途径的vA等于Ⅱ途径的vA | |
| D. | 达到平衡后,第Ⅰ途径混合气密度为第Ⅱ途径混合气密度的$\frac{1}{2}$ |
分析 由反应2A(g)+2B(g)?C(g)+3D(g)可知,反应前后气体的化学计量数相等,压强对平衡移动没有影响,当满足Ⅱ所加物质完全转化为A、B时,与Ⅰ物质的量比值相等,则达到相同平衡状态.据此进行判断.
解答 解:反应2A(g)+2B(g)?C(g)+3D(g)可知,反应前后气体的化学计量数相等,压强对平衡移动没有影响,当满足Ⅱ所加物质完全转化为A、B时,与Ⅰ物质的量比值相等,
A、Ⅱ所加物质完全转化为A、B时,可生成4molA、4molB,与Ⅰ物质的量不相等,平衡状态相同,则系统内混合气体的百分组成相同,故A正确;
B、Ⅱ所加物质完全转化为A、B时,可生成4molA、4molB,与Ⅰ物质的量不相等,平衡状态相同,则系统内混合气体的百分组成相同,故B错误;
C、Ⅱ途径达到平衡时浓度大,压强大,反应速率应较大,故C错误;
D、Ⅰ、Ⅱ为等效平衡状态,体系内混合气体的百分组成相同,混合气体平均相对分子质量相同,由于容器体积相等,Ⅱ气体质量是Ⅰ气体质量的2倍,则达到平衡时,途径Ⅰ的气体密度为途径Ⅱ密度的$\frac{1}{2}$,故D正确;
故选AD.
点评 本题考查等效平衡问题,题目难度中等,注意等效平衡有2种情况:①化学反应前后气体的化学计量数之和不等的反应必须满足物质的量完全相等,②反应前后气体的化学计量数相等,满足物质的量之比相等.


科目:高中化学 来源: 题型:选择题
| A. | SO2通入过量氨水中:SO2+NH3•H2O=NH4++HSO3- | |
| B. | (CH3COO)2Ba溶液中滴入稀硫酸:Ba2++SO42-=BaSO4↓ | |
| C. | 以Ag作电极,电解AgNO3溶液:4Ag++2H2O=4Ag↓+O2↑+4H+ | |
| D. | AgCl悬浊液中加入Na2S溶液:2AgCl+S2-=Ag2S+2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:3 | B. | 3:1 | C. | 1:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 二 | ① | ② | ③ | ||||
| 三 | ⑦ | ④ | ⑤ | ⑥ | |||
| 四 | ⑧ | ⑨ | ⑩ |
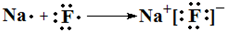 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
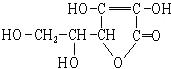
| A. | 分子式为C6H8O6 | B. | 易起氧化及加成反应 | ||
| C. | 可以溶于水 | D. | 在碱性溶液中能稳定地存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1 mol•L-1 NaCl溶液 | B. | 75 mL 0.5mol•L-1CaCl2溶液 | ||
| C. | 150 mL 2 mol•L-1 KCl溶液 | D. | 75 mL 1 mol•L-1AlCl3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com