
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 在空气中金属铝表面迅速氧化形成保护层 | |
| B. | 锌与稀硫酸反应时,加入少量NaHSO4固体时,可使反应速率加快 | |
| C. | 红热的铁丝与冷水接触,表面形成蓝黑色保护层 | |
| D. | 镀锌铁表面有划损时,仍然能阻止铁被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省哈尔滨市高三上学期期中考试化学试卷(解析版) 题型:选择题
某合作学习小组的同学利用下列氧化还原反应设计原电池
2KMnO4+10FeSO4+8H2SO4===2MnSO4+5Fe2(SO4)3+K2SO4+8H2O。盐桥中装有饱和K2SO4溶液,下列叙述中正确的是
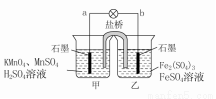
A.乙烧杯中发生还原反应
B.甲烧杯中溶液的pH逐渐减小
C.电池工作时,盐桥中的SO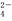 移向甲烧杯
移向甲烧杯
D.外电路的电流方向是从a到b
查看答案和解析>>
科目:高中化学 来源:2017届河南省南阳市高三上学期第三次月考化学试卷(解析版) 题型:选择题
固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体的最外电子层结构,则下列有关说法不正确的是
A.它与水反应的离子方程式为NH4++H-+H2O=NH3·H2O+H2↑
B.NH5中既有共价键又有离子键
C.NH5的电子式为
D.1molNH5中含有5NA个N—H键(NA 表示阿伏加德罗常数)
表示阿伏加德罗常数)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省长春市高二上学期期初考试化学试卷 题型:选择题
已知AgI为黄色沉淀,AgCl为白色沉淀。25°C时,AgI饱和溶液中c(Ag+)为1.22×10-8mol·L-1,AgCl饱和溶液中c(Ag+)为1.30×10-5mol·L-1。若在5mL含有KCl和KI浓度均为0.01mol·L-1的混合溶液中,滴加8mL0.01mol·L-1的AgNO3溶液,则下列叙述中不正确的是
A.溶液中所含溶质的离子浓度大小关系为:
c(K+)>c(NO3—)>c(Cl-)>c(I-)>c(Ag+)
B.溶液中先产生的是AgI沉淀
C.AgCl的Ksp的数值为1.69×10-10
D.若在AgI悬浊液中滴加少量的KCl稀溶液,黄色沉淀不会转变成白色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com