
| A.乙烷气体中混有乙烯,通入氢气,使乙烯发生加成反应 |
| B.氯化钠溶液中混有少量硫酸钠,加入适量硝酸钡溶液,过滤 |
| C.乙醇中混有乙酸,加入氢氧化钠后,分液 |
| D.二氧化碳气体中混有少量的二氧化硫,通入酸性高锰酸钾溶液 |
科目:高中化学 来源:不详 题型:填空题
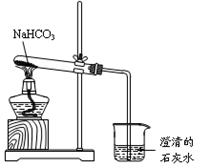
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 00mL0.2000 mol·L-1Na2CO3溶液入锥形瓶中,滴2至3滴甲基橙作指示剂,用未知浓度的盐酸来滴定0.2000 mol·L-1Na2CO3溶液,根据 判断滴定终点达到。
00mL0.2000 mol·L-1Na2CO3溶液入锥形瓶中,滴2至3滴甲基橙作指示剂,用未知浓度的盐酸来滴定0.2000 mol·L-1Na2CO3溶液,根据 判断滴定终点达到。 度升高的平均值为3.41℃,则实验测得中和热△H= (混合后溶液的比热容C = 4.18J·℃-1·g-1),实验测得中和热比理论 (偏高,相等,偏低)
度升高的平均值为3.41℃,则实验测得中和热△H= (混合后溶液的比热容C = 4.18J·℃-1·g-1),实验测得中和热比理论 (偏高,相等,偏低)查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.溴水 | B.浓NaOH溶液 | C.澄清石灰水 |
| D.酸性KMnO4 E.品红溶液,请设计实验方案证明所制得的乙烯中混有CO2、SO2,同时乙烯能与溴水反应。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
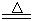 2CaSO4+2Cl2↑+2H2O,该组学生针对上述反应设计如下装置来制取氯气并验证其性质。
2CaSO4+2Cl2↑+2H2O,该组学生针对上述反应设计如下装置来制取氯气并验证其性质。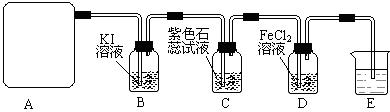
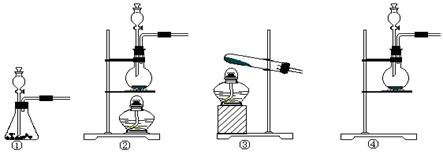
 步骤)
步骤) __________________________ ______________
__________________________ ______________查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
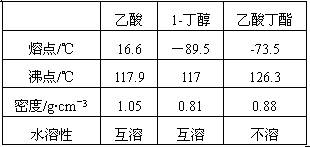
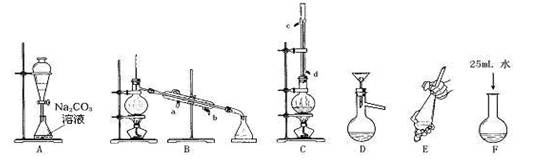
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1:5 | B.1:4 | C.3:1 | D.1:1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 物质(杂质) | 除杂方法 |
| A | CO2(HCl) | 将气体通过盛有饱和NaHCO3溶液的洗气瓶 |
| B | Cl2(HCl) | 将气体通过盛有NaOH溶液的洗气瓶 |
| C | CaCO3(SiO2) | 加入足量盐酸后过滤、洗涤 |
| D | Mg(Al) | 加入足量NaOH溶液后过滤、洗涤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com