

| A. | 制备收集CO2:连接b→d→e | B. | 制备收集H2:连接b→c→g | ||
| C. | 制备收集NH3:连接b→d→e→c | D. | 制备收集Cl2:连接a→f→c→e→d |
分析 A.二氧化碳是酸性氧化物,需要用酸性干燥剂干燥;
B.用排水法收集氢气得不到干燥的氢气;
C.氨气极易溶于浓硫酸,易产生倒吸现象;
D.实验室用浓盐酸和二氧化锰在加热条件下制取氯气,浓盐酸具有挥发性导致生成的氯气中含有氯化氢,HCl极易溶于水,NaCl溶液抑制氯气溶解,HCl是酸性气体,应该用酸性干燥剂干燥,HCl密度大于空气,应该用向上排空气法收集,用碱性物质处理尾气.
解答 解:A.二氧化碳是酸性氧化物,能和碱石灰反应,所以不能用碱石灰干燥,需要用酸性干燥剂干燥,如浓硫酸等,故A错误;
B.用排水法收集氢气时氢气中会含有部分水蒸气,所以得不到干燥的氢气,故B错误;
C.氨气极易溶于浓硫酸,易产生倒吸现象,尾气处理时应该用倒置的漏斗防止倒吸,且可以用水吸收氨气,故C错误;
D.实验室用浓盐酸和二氧化锰在加热条件下制取氯气,所以应该用a装置制备氯气;浓盐酸具有挥发性导致生成的氯气中含有氯化氢,HCl极易溶于水,NaCl溶液抑制氯气溶解,所以可以用饱和食盐水除去氯气中的HCl;HCl是酸性气体,应该用酸性干燥剂干燥,所以可以用浓硫酸干燥;HCl密度大于空气,应该用向上排空气法收集,用碱性物质处理尾气,所以连接顺序是a→f→c→e→d,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及气体制备、干燥、收集和尾气处理,明确实验原理、物质性质是解本题关键,会根据反应物状态和反应条件确定反应装置、根据物质性质差异性除杂、根据气体密度和溶解性确定收集方法,题目难度不大.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:解答题
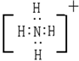 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 产率 | 75% | 65% | 88% | 72% |
| 教师对产率的评价 | 偏低 | 偏低 | 偏高 | 偏低 |
| A. | 第1组:过滤时滤纸有气泡 | |
| B. | 第2组:没有蒸发干,精盐中仍然有水分 | |
| C. | 第3组:过滤时滤液高于滤纸的边缘 | |
| D. | 第4组:滤液中还有少量泥沙就开始蒸发 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,22.4L水的物质的量为1mol | |
| B. | 标准状况下,1mol任何气体所占的体积都约为22.4L/mol | |
| C. | 标准状况下,1mol氦气的质量为4g,其所占的体积约为22.4L | |
| D. | 常温常压下,1mol CO2所占的体积不可能等于22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
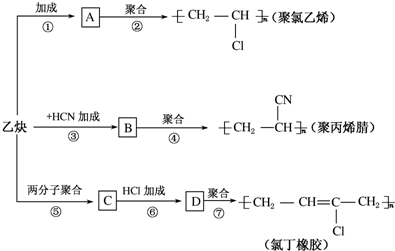
 ;
;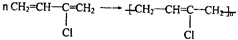 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
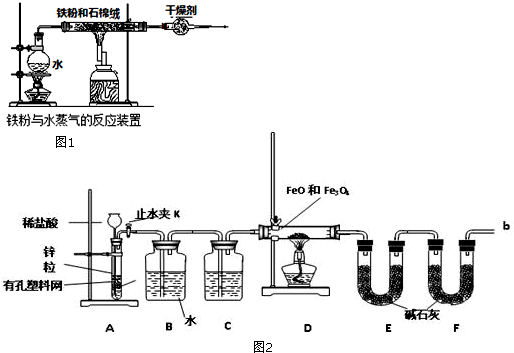
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com