

| 优等品 | 一等品 | 合格品 | |
| 外观 | 白色结晶,无可见机械杂质 | 无可见机械杂质 | |
| 氮(N)含量 | ≥21.0% | ≥21.0% | ≥20.5% |

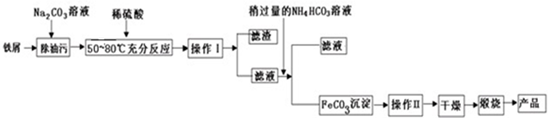
分析 制取摩尔盐晶体流程为:碳酸钠溶液呈碱性,加热促进碳酸钠水解导致溶液碱性增强,碱促进油脂水解,所以碳酸钠的作用是除去铁表面的油污,然后加稀硫酸溶解,铁和稀硫酸反应生成硫酸亚铁,趁热过滤,然后加入硫酸铵发生(NH4)2 SO4+FeSO4+6H2O=(NH4)2SO4•FeSO4•6H2O↓,结晶过滤,摩尔盐易溶于水,难溶于有机溶剂,用酒精洗涤摩尔盐,得到摩尔盐晶体;
I.(1)碳酸钠溶液为碱性溶液,促进油脂水解;加热促进碳酸钠水解导致碱性增强;
(2)摩尔盐易溶于水而难溶于有机溶剂;
II.(1)水具有挥发性,加热时促进挥发,导致制得的氨气中含有水蒸气;
(2)NH4++OH-═NH3↑+H2O,NaOH足量时使得NH4+全部转化为NH3,加热将气体进入B装置;
(3)根据N原子守恒计算m(N)质量,从而计算其含氮量.
解答 解:制取摩尔盐晶体流程为:碳酸钠溶液呈碱性,加热促进碳酸钠水解导致溶液碱性增强,碱促进油脂水解,所以碳酸钠的作用是除去铁表面的油污,然后加稀硫酸溶解,铁和稀硫酸反应生成硫酸亚铁,趁热过滤,然后加入硫酸铵发生(NH4)2 SO4+FeSO4+6H2O=(NH4)2SO4•FeSO4•6H2O↓,结晶过滤,摩尔盐易溶于水,难溶于有机溶剂,用酒精洗涤摩尔盐,得到摩尔盐晶体;
I.(1)碳酸钠为强碱弱酸盐,碳酸根离子水解导致溶液呈碱性,碱能促进油脂水解且升高温度促进碳酸钠水解,导致溶液碱性增强,所以用碳酸钠洗涤油脂,水解方程式为CO32-+H2O?HCO3-+OH-,
故答案为:洗涤铁屑表面的油污;CO32-+H2O?HCO3-+OH-,加热促进CO32-的水解,增大OH-浓度
;
(2)摩尔盐易溶于水而难溶于有机溶剂乙醇,所以用乙醇洗涤摩尔盐而不是用水洗涤,
故答案为:摩尔盐易溶于水而难溶于乙醇;
II.(1)水具有挥发性,加热时促进挥发,导致制得的氨气中含有水蒸气,导致测定值偏高,为减少误差,应该有干燥氨气装置,
故答案为:偏高;缺少干燥装置;
(2)NH4++OH-═NH3↑+H2O,NaOH足量时使得NH4+全部转化为NH3,加热将气体进入B装置,所以需要NaOH足量且加热,故答案为:NH4++OH-═NH3↑+H2O,NaOH足量时使得NH4+全部转化为NH3,加热将气体进入B装置;
(3)根据N原子守恒得(NH4)2SO4---2NH3,B装置增加的质量为氨气质量,则m(N)=n(N)M(N)=n(NH3)M(N)=$\frac{6.8g}{17g/mol}$×14g/mol=5.6g,则该化肥含氮量=$\frac{5.6g}{27.0g}$×100%=20.7%,所以为合格品,
故答案为:20.7%.
点评 本题考查物质制备,涉及物质制取、盐类水解、实验评价、化学方程式的计算等知识点,侧重考查学生实验操作、实验分析及计算能力,注意原子守恒的灵活运用,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤、蒸发、结晶、溶解 | B. | 溶解、蒸发、结晶、过滤 | ||
| C. | 溶解、蒸发、过滤、结晶 | D. | 溶解、过滤、蒸发、结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
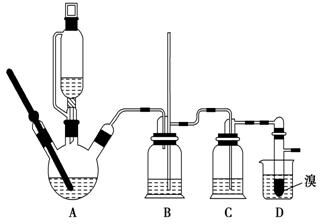 实验室制备1,2二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2═CH2+H2O CH2═CH2+Br2→BrCH2CH2Br
实验室制备1,2二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2═CH2+H2O CH2═CH2+Br2→BrCH2CH2Br| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
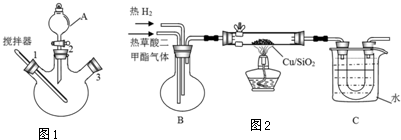
| 物质 | 熔点 | 沸点 | 水溶性 | 相对分子质量 |
| 乙二醇 | -12.9℃ | 197.3℃ | 溶于水、醇 | 62 |
| 甲醇 | -97℃ | 64.7℃ | 与水互溶 | 32 |
| 草酸二甲酯 | 54℃ | 163.5℃ | 微熔于冷水,溶于醇和醚 | 118 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
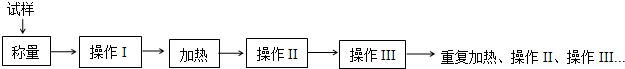
| 加热前质量 | 加热后质量 | ||
| m1 | m2 | m3 | m4 |
| 5.400g | 7.900g | 6.900g | 6.901g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| C(NH3)/mol•L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com