
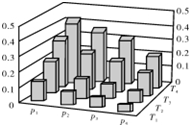
| A. | P1>P2>P3>P4 | |
| B. | 甲醇的物质的量分数越高,反应的平衡常数越大 | |
| C. | 若T1>T2>T3>T4,则该反应为放热反应 | |
| D. | 缩小容积,可以提高CH3OH在混合物中的质量分数 |
分析 A、增大压强,平衡正向移动,结合图象判断甲醇的物质的量分数变化情况判断压强大小;
B、平衡常数只受温度的影响;
C、若T1>T2>T3>T4,降低温度,甲醇(CH3OH)的物质的量分数增大,则平衡正向移动,则该反应为放热反应;
D、缩小容积增大压强,平衡正向移动.
解答 解:A、增大压强,平衡正向移动,则反应混合物中甲醇(CH3OH)的物质的量分数逐渐增大,即P1>P2>P3>P4,故A正确;
B、平衡常数只受温度的影响,△H<0,升高温度,平衡逆向移动,甲醇的物质的量分数减小,反应的平衡常数减小,但甲醇的物质的量分数的高低和反应的平衡常数之间没有关系,故B错误;
C、若T1>T2>T3>T4,降低温度,甲醇(CH3OH)的物质的量分数增大,则平衡正向移动,则该反应为放热反应,故C正确;
D、缩小容积增大压强,平衡正向移动,可以提高CH3OH在混合物中的质量分数,故D正确;
故选B.
点评 本题考查学生化学平衡的影响因素以及化学平衡的计算知识,属于综合知识的考查,难度不大.


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
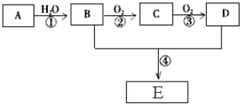 已知A是一种气态烃,标况下的密度为1.25g/L,现以A为主要原料合成一种具有果香味的物质E,其合成路线如图所示.
已知A是一种气态烃,标况下的密度为1.25g/L,现以A为主要原料合成一种具有果香味的物质E,其合成路线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水 | B. | 脂肪类物质 | C. | 淀粉类物质 | D. | 蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
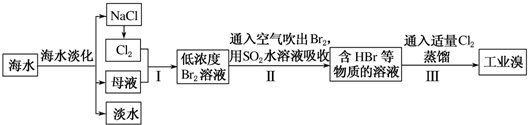
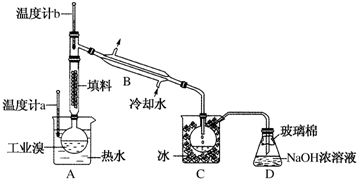
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12.5% | B. | 25% | C. | <25% | D. | >25% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gC含有9NA个电子 | |
| B. | 标准状况下22.4LCCl4含有4NA个氯原子 | |
| C. | 标准状况下,33.6LN2和H2的混合气体中含3NA个原子 | |
| D. | 2.709×1024个原子的水分子含有1.5NA个氧原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com