
【题目】A、B、C、D均为中学化学常见物质,且均含有同一种元素,它们之间有如下转化,其中A是单质。
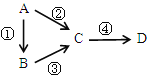
(1)若C是淡黄色固体常用于呼吸面具中的供氧剂,D是一种强碱。则C作供氧剂时与CO2反应的化学方程式为_______________________;其中还原剂是________,氧化产物是___________,7.8g C参加反应时转移的电子数是___________。
(2)若B、D既能溶于强酸溶液,又能溶于强碱溶液,反应②③均需要强碱性溶液,反应④可以通过滴加少量稀盐酸实现。据此写出A元素的原子结构示意图是______。请写出A用于焊接铁轨的化学方程式___________________________。请写出②的离子方程式_____________________________。
【答案】 2Na2O2 + 2CO2 == 2Na2CO3 + O2 Na2O2 O2 0.1NA或6.02×1022 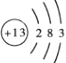 2Al + Fe2O3
2Al + Fe2O3![]() 2Al2O3 + Fe 2Al + 2OH- + 2H2O = 2AlO2- +3H2↑
2Al2O3 + Fe 2Al + 2OH- + 2H2O = 2AlO2- +3H2↑
【解析】(1)C是一种淡黄色固体,常用于吸吸面具中的供氧剂,D是一种强碱,则C为Na2O2,D为NaOH;
(2)B、D既能溶于强酸溶液,又能溶于强碱溶液,反应②③均需要强碱性溶液,反应④可以通过滴加少量稀盐酸实现,则A为Al,B为Al2O3,D为Al(OH)3;据此分析解答。
(1)C是一种淡黄色固体,常用于吸吸面具中的供氧剂,D是一种强碱,则C为Na2O2,D为NaOH,过氧化钠和二氧化碳反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,Na2O2中O元素的化合价既升高,又降低,因此过氧化钠既是氧化剂,又是还原剂,元素化合价升高的失电子发生氧化反应,得到氧化产物,氧化产物为氧气,元素化合价降低得到电子发生还原反应得到还原产物,还原产物为碳酸钠;7.8g过氧化钠的物质的量为![]() =0.1mol,转移的电子为0.1mol,故答案为:2Na2O2 + 2CO2 == 2Na2CO3 + O2;Na2O2;O2;0.1NA或6.02×1022;
=0.1mol,转移的电子为0.1mol,故答案为:2Na2O2 + 2CO2 == 2Na2CO3 + O2;Na2O2;O2;0.1NA或6.02×1022;
(2)B、D既能溶于强酸溶液,又能溶于强碱溶液,反应②③均需要强碱性溶液,反应④可以通过滴加少量稀盐酸实现,则A为Al,B为Al2O3,C为NaAlO2,D为Al(OH)3。铝为13号元素,原子结构示意图为 ,铝热反应可以用于焊接铁轨,反应的化学方程式为2Al + Fe2O3
,铝热反应可以用于焊接铁轨,反应的化学方程式为2Al + Fe2O3![]() 2Al2O3 + Fe,②的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:
2Al2O3 + Fe,②的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为: ;2Al + Fe2O3
;2Al + Fe2O3![]() 2Al2O3 + Fe;2Al+2OH-+2H2O=2AlO2-+3H2↑。
2Al2O3 + Fe;2Al+2OH-+2H2O=2AlO2-+3H2↑。


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关化学研究的正确说法是( )
A. 同时改变两个变量来研究反应速率的变化,能更快得出有关规律
B. 从HF、HCl、HBr、HI酸性递增的事实,推出F、、Cl、Br、I的非金属递增的规律
C. 利用“海水→氢氧化镁→氯化镁→金属镁”的工艺流程生产金属镁
D. 依据丁达尔现象可将分散系分为溶液、胶体与浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素A、B、C、D的性质或结构信息如下:
信息:①原子半径:A<B<C<D。②四种元素之间形成的某三种分子的比例模型及部分性质如下:
物质 | 比例模型图 | 存在或性质 |
甲 |
| 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二 |
乙 |
| 无色,无气味并且易燃。是常见的一种基础能源 |
丙 |
| 有强氧化性的弱酸,有漂白性,可用于消毒杀菌 |
请根据上述信息回答下列问题。
(1)A的元素符号是__________;C元素在元素周期表中的位置是_______;甲的电子式是_______。
(2)丙可由D元素的单质与物质甲反应得到,该反应的离子方程式是________;D所在周期中,E元素的单质还原性最强,则E的单质与甲反应后的溶液呈_______(填“酸”或“碱”)性,用电离方程式表示其原因是___________________________。
(3)①A、B、C元素可组成多种化合物。由A、C组成的一种化合物丁,其产量常常用来衡量一个国家石油化工发展水平,则实验室中可用来除去乙中少量丁的试剂是_________。
②A、B、C组成的化合物中,有2种化合物的化学式均为C2A6B,则这2种化合物的关系互称为_________。为了鉴别这两种化合物,某同学用一小块E的单质分别投入盛有这2种化合物的试管中,其中与E的单质发生反应的化学方程式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天宫二号空间实验室于2016年9月15 日在酒泉卫星发射中心发射成功。实验室承载了10余项太空实验,其中包含了好比科幻英维“综合材料”多晶碲化锌(ZnTe)的实验。
(1)电负性Zn___________Te(填“>”或“<”或“=”)。
(2)O、S、Se与Te元素位于同一主族。基态碲(Te)原子核外电子排布式为[Kr]________,有_______个未成对电子。
(3)H2O、H2S、H2Se沸点由低到高顺序为______,推断的依据是_______;SO2分子中S原子采取_____杂化;用价层电子对互斥理论解释SO42-的键角大于SO32-的原因是____________。
(4)向氯化锌溶液中加入过量的氨水,得到[Zn(NH3)4]Cl2,此配位化合物中含有的化学键有共价键、____、_______。
(5)碲化锌晶体有两种结构,其中一种晶胞结构如下图:

晶胞中含有_____个Te原子;与Te原子距离最近的Te原子有______个;若两个距离最近的Te原子间距为apm.则晶体密度为_________g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用下列装置(仪器可重复使用)制备PH3并证明PH3具有强还原性和热不稳定性。已知: ①标准状态时PH3是一种无色、微溶于水、有剧毒的气体,具有强还原性,在空气中能自燃; ②白磷(P4)常温下为白色或黄色蜡状固体,不溶于水,在空气中易自燃;③乙醚是一种易挥发的液体,沸点34.6℃,能溶解白磷。
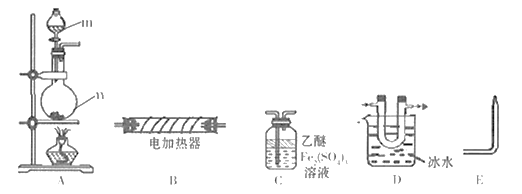
(1)仪器m的名称为_________,装置C名称为____________。
(2)实验室用白磷与NaOH浓溶液反应生成NaHPO2的同时制得PH3,反应的化学方程式为___________。
(3)用装置A制取PH3,实验前,在仪器n中加入适量的乙醚和白磷并微热,然后才滴入浓NaOH溶液。实验前先微热的目的是___________。
(4)将A、C、E依次相连,按照(3)中操作滴入浓NaOH溶液后,同时点燃E处导出的气体,若装置C中溶液黄色变浅,同时得到白色蜡状固体,说明PH3具有____性,装置C中发生的化学反应方程式为_________,点燃E处气体的目的为______________。
(5)将以上装置组合以证明PH3受热已分解,并验证PH3受热分解的气体产物,则仪器连接顺序为
A![]()
![]() D
D![]()
![]() ______
______![]() E( 在“
E( 在“![]() ”之间的空白处填写装置编号)。
”之间的空白处填写装置编号)。
能证明PH3分解的气体产物的现象是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20mL 1molL﹣1的Al2(SO4)3溶液中加入20mLNaOH溶液,充分反应可得1.56g沉淀,则加入的NaOH溶液的物质的量浓度可能是____、____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Hagemann酯的合成路线如下(部分反应条件略去):

(1)Hagemann酯的分子式为_____________。
(2)已知A→B、B→C均为加成反应,则B的结构简式是__________。
(3)E→F的化学方程式是_______________。
(4)已知Hagemann酯的一种同分异构体有下列结构特征:
①含有苯环且苯环上只有一个取代基;②除苯环外核磁共振氢谱吸收峰只有1个;③存在甲氧基(-OCH3)。则该同分异构体的结构简式为____________。
(5)下列说法正确的是________________。
①G为芳香族化合物
②A能和HCl加成得到聚氯乙烯的单体
③G与NaOH溶液共热,能得到甲醇
④在Ni催化下,1molHagemann酯最多能与2 mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(密度为1.84 g·cm-3)配制1mol·L-1的稀硫酸100mL,配制溶液时可能用到的仪器有①玻璃棒;②胶头滴管;③100mL容量瓶;④托盘天平;⑤50mL烧杯;⑥10mL量筒。则正确的选用顺序是 ( )
A.⑥③⑤①②B.⑥⑤③①②
C.④⑤③②①D.⑥⑤①③②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 蔗糖溶液不能导电,蔗糖溶液是非电解质
B. 盐酸能导电的原因是溶液在通电作用下产生了自由移动的离子
C. 酒精在水溶液中和熔融状态下都不导电,酒精是非电解质
D. 氯化钠和硫酸都是电解质,所以它们熔融状态下都能导电
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com