


分析 实验一、干海带在坩埚中灼烧,然后加水溶解,煮沸后过滤得到含碘离子的溶液,
实验二、海带浸取液中通入氧气调节溶液PH,得到含I2的水溶液,加入有机溶剂四氯化碳萃取分液得到含I2的CCl4溶液,方案乙是:步骤Y利用氢氧化钠溶液吸收分液得到上层溶液中是NaI和NaIO3,加入H2SO4溶液发生归中反应得到I2的水溶液,过滤得到粗碘蒸馏提纯得到纯净碘单质,方案甲是直接蒸馏得到碘单质,以此解答该题.
解答 解:(1)步骤X加入四氯化碳,为萃取操作,常用到的仪器为分液漏斗,故答案为:萃取;分液漏斗;
(2)A.发生反应3I2+6NaOH═5NaI+NaIO3+3H2O中,需要浓氢氧化钠溶液,所以应控制NaOH溶液的浓度和体积,故A正确;
B.根据反应3I2+6NaOH═5NaI+NaIO3+3H2O可知,步骤Y将碘转化成离子进入水层,故B正确;
C.经该操作后可将两层溶液分开,为分液操作,故C错误;
D.乙醇易溶于水和四氯化碳,将氢氧化钠换成乙醇,仍然无法分离出碘单质,故D错误;
故答案为:AB;
(3)在酸性条件下,I-和IO3-反应生成I2,发生反应的离子方程式为5I-+IO3-+6H+=3I2+3H2O,
故答案为:5I-+IO3-+6H+=3I2+3H2O;
(4)步骤Z将碘单质和水分离,由于碘单质在水中的溶解度较小,可通过过滤操作完成,故答案为:过滤;
(5)方案甲中采用蒸馏操作,由于碘单质容易升华,会导致碘单质损失,所以甲方案不合理,故答案为:主要由于碘易升华,会导致碘的损失.
点评 本题考查物质的分离与提纯方法的综合应用,题目难度较大,试题涉及的知识点较多、综合性较强,充分考查学生的分析、理解能力及化学实验能力,明确实验原理为解答关键,注意熟练掌握化学实验基本操作方法.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,由于醚键比较稳定故利用 此反应可保护醛基,也可以合成缩醛类有机物,下列说法中不正确的是( )
,由于醚键比较稳定故利用 此反应可保护醛基,也可以合成缩醛类有机物,下列说法中不正确的是( )| A. | 保护 1mol 醛基时也可用2molCH3CH2OH | |
| B. | 合成 1mol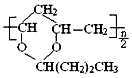 需要 1mol 需要 1mol 和 nmolCH3CH2CH2CHO 和 nmolCH3CH2CH2CHO | |
| C. | 通过上述反应合成的 其核磁共振氢谱中峰面积之比为1:1:1:1:1:2:2:3 其核磁共振氢谱中峰面积之比为1:1:1:1:1:2:2:3 | |
| D. | 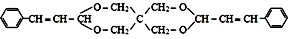 可由 C(CH2OH)4 与 可由 C(CH2OH)4 与 通过上述反应得到 通过上述反应得到 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 .
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 有机物A、B均为合成某种抗支气管哮喘药物的中间体,如图所示,A在一定条件下可转化为B,下列说法错误的是( )
有机物A、B均为合成某种抗支气管哮喘药物的中间体,如图所示,A在一定条件下可转化为B,下列说法错误的是( )| A. | 分子B中只含有3种官能团 | |
| B. | 分子A中所有碳原子不可能位于同一平面 | |
| C. | 分子B能发生银镜反应,但不能发生水解反应 | |
| D. | 用FeCl3溶液可检验物质B中是否混有A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{△{H}_{1}}{△{H}_{2}}$mol | B. | $\frac{2△{H}_{1}}{△{H}_{2}}$mol | C. | $\frac{△{H}_{1}}{2△{H}_{2}}$mol | D. | -$\frac{△{H}_{1}}{2△{H}_{2}}$mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com