
| A�� | NaOH��Һ��SO2��Ӧ����n��NaOH����n��SO2��=4��3ʱ��4OH-+3SO2=SO32-+2HSO3-+H2O | |
| B�� | ��1mol��NaOH��Һ��ͨ��1mol��H2S���壺H2S+2OH-=S2-+2H2O | |
| C�� | Ca��HCO3��2��Һ������NaOH��Һ��Ӧ��HCO3-+Ca2++OH-=CaCO3��+H2O | |
| D�� | 1mol/L��NaAlO2��Һ��2.5mol/L��HCl�����������Ȼ�ϣ�2AlO2-+5H+=Al��OH��3��+Al3++H2O |
���� A���ռ���Һ��ͨ��������������Ӧ�����������ƣ�ͨ��������������������������ƣ�����Sԭ�Ӻ�Naԭ���غ���д���ӷ���ʽ��
B������ͨ�뵽���������з������������ⷴӦΪ2NaOH+H2S=Na2S+2H2O����ͨ�����NaOH+H2S=NaHS+H2O��
C��NaOH��������̼��ơ�̼�����ƺ�ˮ��
D������Һ���Ϊ1L��ƫ�����ƺ�HCl�����ʵ����ֱ�Ϊ1mol��2.5mol��1molƫ����������1molHCl����1mol����������ʣ���1.5molHCl�ܹ��ܽ�0.5mol�����������ݴ��жϷ�Ӧ���P���ӷ���ʽ��
��� �⣺A���ռ���Һ��ͨ��������������Ӧ�����������ƣ�n��NaOH����n��SO2��=2��1��Ӧ�����������ƣ�ͨ��������������������������ƣ�n��NaOH����n��SO2��=1��1����Ӧ�������������ƣ���2��1��1��1��Χ�������������ƺ����������ƣ���n��NaOH����n��SO2��=4��3ʱ������ΪNa2SO3��NaHSO3������Sԭ�Ӻ�Naԭ���غ㣬[2n��SO32-��+n��HSO3-��]��[n��SO32-��+n��HSO3-��]=4��3��n��SO32-����n��HSO3-��=1��2���������ӷ���ʽΪ��4OH-+3SO2=SO32-+2HSO3-+H2O����A��ȷ��
B����1mol��NaOH��Һ��ͨ��1mol��H2S���巢��NaOH+H2S=NaHS+H2O�����ӷ�ӦΪ��H2S+OH-=HS-+H2O����B����
C��Ca��HCO3��2��Һ������NaOH��Һ��Ӧ���ӷ��̣�Ca2++HCO3-+OH-�TCaCO3��+H2O����C��ȷ��
D��1mol/L��NaAlO2��Һ��2.5mol/L��HCl��Һ�����������Ȼ�ϣ�����Һ���Ϊ1L��ƫ�����ƺ�HCl�����ʵ����ֱ�Ϊ1mol��2.5mol��1molƫ����������1molHCl����1mol����������ʣ���1.5molHCl�ܹ��ܽ�0.5mol������������Ӧ�����ӷ���ʽΪ��2AlO2-+5H+�TAl3++Al��OH��3��+H2O����D��ȷ��
��ѡB��
���� ���⿼�����ӷ���ʽ��д�����ؿ��������йص����ӷ���ʽ��д��Ϊ�߿��ȵ㣬��ȷ��Ӧʵ���ǽ���ؼ���������ѧ���ļ��������ͷ��������ģ�Ӧע���غ㷽���ڼ����е�Ӧ�ã�Aѡ��Ϊ������ѵ㣬DΪ�״��㣬��Ŀ�Ѷ��еȣ�


 ���100�ֵ�Ԫ�Ż�������ϵ�д�
���100�ֵ�Ԫ�Ż�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �غ�ɫNO2��ѹ����ɫ�ȱ�����dz | |
| B�� | �Ӵ�����ʹ N2��H2��һ��������ת��ΪNH3 | |
| C�� | ����Ũ��ˮ��NaOH���������ȡ���� | |
| D�� | ��ѹ������������SO2��O2��Ӧ����SO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
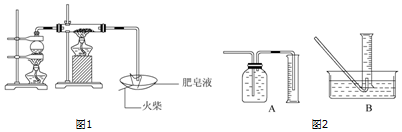
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
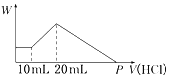 ҽѧ�ϳ������Ը��������Һ�Ͳ�����Һ�ķ�Ӧ���ڲⶨѪ�Ƶĺ������ش��������⣺
ҽѧ�ϳ������Ը��������Һ�Ͳ�����Һ�ķ�Ӧ���ڲⶨѪ�Ƶĺ������ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
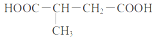
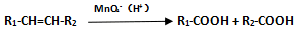
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
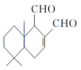 ij��Ȼ��ʳ�ؾ��з�������Ⱥ�������ã���ṹ��ʽ��ͼ��δ��ʾ��ԭ�ӻ�ԭ���ŵĿռ����У����þ�ʳ��������ij�Լ���ַ�Ӧ�������л�����ӵĹ������������٣�����Լ��ǣ�������
ij��Ȼ��ʳ�ؾ��з�������Ⱥ�������ã���ṹ��ʽ��ͼ��δ��ʾ��ԭ�ӻ�ԭ���ŵĿռ����У����þ�ʳ��������ij�Լ���ַ�Ӧ�������л�����ӵĹ������������٣�����Լ��ǣ�������| A�� | H2 | B�� | Cu��OH��2����Һ | C�� | HBr | D�� | Br2��CCl4��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| �� �� | ���ͻ���� | |
| A | SO2ʹ���Ը��������Һ��ɫ | SO2����Ư���� |
| B | Ũ�����ڹ��������±�� | Ũ����ȶ���������ɫ������������Ũ���� |
| C | ��Na2CO3��ͨ������CO2����Һ����� | ������NaHCO3 |
| D | �����£���FeCl3��Һ�еμ�����KI��Һ���ٵμӼ��ε�����Һ����Һ����ɫ�� | Fe3+�������Ա�I2��ǿ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
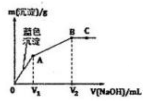 ��MgCl2��CuCl2����Һ����μ���0.1 mol•L-1��NaOH��Һ��������������m�������NaOH��Һ�����V���Ĺ�ϵ��ͼ��ʾ����֪V2=3V1������˵����ȷ���ǣ�������
��MgCl2��CuCl2����Һ����μ���0.1 mol•L-1��NaOH��Һ��������������m�������NaOH��Һ�����V���Ĺ�ϵ��ͼ��ʾ����֪V2=3V1������˵����ȷ���ǣ�������| A�� | ˮ�ĵ���̶ȣ�A��B��C | |
| B�� | ��ʵ�鲻��֤��Cu��OH��2��Ksp��Mg��OH��2��KspС | |
| C�� | ԭ��Һ��MgCl2��CuCl2�����ʵ���Ũ����� | |
| D�� | ����Mg��OH��2����Һ�м���CuCl2��Һ��һ������Cu��OH��2���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��̼�������Һ�м��������NaOH��Һ��Ca2++HCO3-+OH-�TCaCO3��+H2O | |
| B�� | ��NH4Al��SO4��2��Һ�еμ�Ba��OH��2��ҺʹSO42-��ȫ������NH4++Al3++2SO42-+2Ba2++4OH-�TNH3•H2O+Al��OH��3��+2BaSO4�� | |
| C�� | ����������Һ��������SO2���壺SO2+2OH-�TSO32-+H2O | |
| D�� | ��״���£���1.12LCO2����ͨ��1L0.1mol/L��NaAlO2��Һ�У�CO2+2H2O+AlO2-�TAl��OH��3��+HCO3- |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com