
【题目】下列物质的制备与工业生产相符的是
①NH3![]() NO
NO![]() HNO3
HNO3
②浓HCl![]() Cl2
Cl2 ![]() 漂白粉
漂白粉
③MgCl2(aq)![]() 无水MgCl2
无水MgCl2![]() Mg
Mg
④饱和NaCl(aq)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
⑤铝土矿![]() NaAlO2溶液
NaAlO2溶液![]() Al(OH)3
Al(OH)3![]() Al2O3
Al2O3![]() Al
Al
A. ①④⑤ B. ①③⑤ C. ②③④ D. ②④⑤
科目:高中化学 来源: 题型:
【题目】(1)室温下,2g苯(C6H6)完全燃烧生成液态水和CO2,放出83.6kJ的热量,写出1molC6H6完全燃烧的热化学方程式:______。
(2)已知:Fe2O3(s)+![]() C(s)=
C(s)=![]() CO2(g)+2Fe(s)△H=+akJmol-1;C(s)+O2(g)=CO2(g)△H=-bkJmol-1,则2Fe(s)+
CO2(g)+2Fe(s)△H=+akJmol-1;C(s)+O2(g)=CO2(g)△H=-bkJmol-1,则2Fe(s)+![]() O2(g)=Fe2O3(s)的△H=________。
O2(g)=Fe2O3(s)的△H=________。
(3)已知几种化学键的键能如表所示:
化学键 | Cl—Cl | F—F | Cl—F |
键能/ kJ·mol—1 | 242 | 159 | 172 |
则反应Cl2(g)+3F2(g)![]() 2ClF3(g)的△H=_____________ kJ·mol-1。
2ClF3(g)的△H=_____________ kJ·mol-1。
(4)如图是乙烷、二甲醚燃烧过程中的能量变化图。
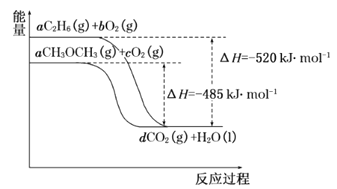
请回答下列问题:
①乙烷的燃烧热ΔH=_______kJ·mol-1。
②根据题图写出二甲醚完全燃烧时的热化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制取SO2并验证SO2的某些性质的装置,请回答:

(1)在⑥中发生反应的化学方程式为______________________________________。
(2)①中的实验现象为石蕊溶液____________,此实验证明SO2具有____________的性质。
(3)②中的品红溶液________,证明SO2有________性。
(4)③中的实验现象是________________________,证明SO2有____________性。
(5)④中的实验现象是______,证明SO2有______性。
(6)⑤的作用是____________,反应的化学方程式为____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探索CO和NO2这类化合物的特征及反应机理,对处理该类化合物的污染问题具有重要意义。回答下列问题:
I.CO可以与H2反应制备合成天然气(SNG)。涉及反应如下:
CO甲烷化:CO(g)+3H2(g)CH4(g)+H2O(g)![]() 1=-206.2kJ·mol-1
1=-206.2kJ·mol-1
水煤气变换:CO(g)+H2O(g)CO2(g)+H2(g)![]() 2=-41.2kJ·mol-1
2=-41.2kJ·mol-1
(1)反应CO2(g)+4H2(g) CH4(g)+2H2O(g)的![]() =_____kJ·mol-1。某温度下,分别在起始体积相同的恒容容器A、恒压容器B中加入1molCO2和4molH2的混合气体,两容器反应达平衡后放出或吸收的热量较多的是_____(填“A”或“B”)。
=_____kJ·mol-1。某温度下,分别在起始体积相同的恒容容器A、恒压容器B中加入1molCO2和4molH2的混合气体,两容器反应达平衡后放出或吸收的热量较多的是_____(填“A”或“B”)。
(2)在恒压管道反应器中将原料气H2和CO按一定比例通入,在催化剂作用下制备合成天然气,400℃、p总为100kPa时反应体系平衡组成如表所示。
组分 | CH4 | H2O | H2 | CO2 | CO |
体积分数 | 45.0 | 42.5 | 10.0 | 2.00 | 0.500 |
该条件下CO的总转化率α=______。若将管道反应器升温至500℃,反应达到平衡后CH4的体积分数![]() ______45.0%(填“>”、“<”或“=”)。
______45.0%(填“>”、“<”或“=”)。
II.NO2可发生二聚反应生成N2O4,化学方程式为2NO2![]() N2O4。该反应达到平衡后,升高温度可使体系颜色加深。
N2O4。该反应达到平衡后,升高温度可使体系颜色加深。
(3)已知该反应的正反应速率方程为υ正=k正·c2(NO2),逆反应速率方程为υ逆=k逆·c(N2O4),其中k正、k逆分别为正、逆反应的速率常数。则右图(lgk表示速率常数的对数;![]() 表示温度的倒数)所示①、②、③、④四条斜线中,能表示lgk正随
表示温度的倒数)所示①、②、③、④四条斜线中,能表示lgk正随![]() 变化关系的是斜线______,能表示lgk逆随
变化关系的是斜线______,能表示lgk逆随![]() 变化关系的是斜线______。
变化关系的是斜线______。

(4)图中A、B、C、D点的纵坐标分别为a+1.5、a+0.5、a-0.5、a-1.5,则T1温度时化学平衡常数K=______mol-1·L。已知T1温度时,某时刻恒容密闭容器中NO2、N2O4浓度均为0.2mol·L-1,此时υ正______υ逆(填>或<);该反应达到平衡后,若将温度从T1升高到T2重新达到平衡,则T1温度时平衡压强p(T1)______T2温度时平衡压强p(T2)(填“>”、“=”或“<”),原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将x molA与y mol B充入密闭容器中发生如下反应:xA(g)+yB(g)![]() zC(g);ΔH=-akJ·mol-1(a>0)
zC(g);ΔH=-akJ·mol-1(a>0)
在某温度下达到平衡状态,请回答下列问题:
(1)若减压后v正<v逆,则x、y、z的关系是____。
(2)若恒温、恒压下向原平衡中加入C,则平衡_____移动(填“正向”、“逆向”或“不”),重新达平衡后C的体积分数_____(填“增大”、“减小”或“不变”)。
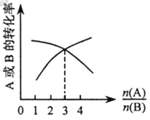
(3)如图,纵坐标为反应物的转化率,横坐标是反应物初始用量之比![]() ,则x∶y =___;
,则x∶y =___;![]() 一定时,平衡状态A的转化率在恒温条件下比在绝热环境中是高还是低?____。
一定时,平衡状态A的转化率在恒温条件下比在绝热环境中是高还是低?____。
(4)恒温、恒容下,x mol A与y mol B反应达到平衡时能量变化为a1 kJ,xmolA与1.5ymolB反应达到平衡时能量变化为a2kJ,则a、a1、a2、由大到小顺序为____。(a、a1、a2均大于0)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且产物的成分与温度高低有关.当n(KOH)=amol时,下列有关说法错误的是( )
A. 某温度下,反应后c(Cl﹣):c(ClO﹣)=6,则溶液中c(ClO﹣):c(ClO3﹣)=1
B. 参加反应的氯气的物质的量等于0.5amol
C. 改变温度,反应中转移电子的物质的量n的范围:![]() amol<n<
amol<n<![]() amol
amol
D. 改变温度,产物中KClO3的最大理论产量为![]() amol
amol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国圣路易斯大学研制了一种新型的乙醇电池,电池如下图所示:
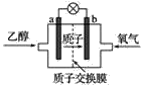
该电池用质子(H+)溶剂,在200 ℃左右时供电。电池总反应为C2H5OH+3O2===2CO2+3H2O。下列说法正确的是( )
A.乙醇在电池的负极上参加反应
B.电池工作时,电子由b极沿导线经灯泡再到a极
C.电池工作时,电源内部的氢离子从正极区向负极区迁移
D.电池工作时,1 mol乙醇被氧化时可转移6 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
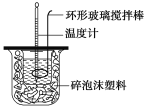
(1)写出该反应的热化学方程式(中和热为57.3 kJ·mol-1):_____。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如表。
①请填写表中的空白:
温度 实验次数 | 起始温度T1/℃ | 终止温度 T2/℃ | 温度差平 均值(T2 -T1)/℃ | ||
H2SO4 溶液 | NaOH 溶液 | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ___ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50mol·L-1NaOH溶液和0.50mol·L-1硫酸溶液的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18J·g-1·℃-1。则中和热ΔH=____(取小数点后一位)。
③上述实验数值结果与57.3kJ·mol-1有偏差,产生偏差的原因可能是____(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各组物质中,找出合适的序号填在对应的空格内:
①NO2和N2O4 ②12C和14C ③40 19K和40 20Ca
④异戊烷(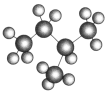 )
)
和新戊烷(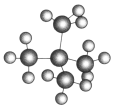 )
)
⑤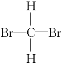 和
和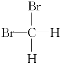 ⑥甲烷和丙烷
⑥甲烷和丙烷
(1)互为同位素的是________。
(2)互为同分异构体的是________。
(3)互为同系物的是________。
(4)为同一种物质的是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com