
| A. | 向FeI2溶液中通入等物质的量的Cl2:2I-+Cl2═2Cl-+I2 | |
| B. | 用过量氨水吸收烟道气中的SO2:SO2+NH3•H2O═HSO3-+NH4+ | |
| C. | 向NaHSO4溶液中加入Ba(OH)2至中性:H++SO42-+Ba2++OH-═H2O+BaSO4↓ | |
| D. | 向AgCl饱和溶液中滴加Na2S溶液:2AgCl+S2-═Ag2S+2Cl- |
分析 A.碘离子的还原性强于二价铁离子,氯气先氧化碘离子;
B.二氧化硫少量,反应生成亚硫铵;
C.向NaHSO4溶液中加入Ba(OH)2至中性,二者物质的量之比2:1;
D.向AgCl饱和溶液中滴加Na2S溶液,反应生成硫化银沉淀和氯离子.
解答 解:A.向FeI2溶液中通入等物质的量的Cl2:,氯气少量只氧化碘离子,离子方程式:2I-+Cl2═2Cl-+I2,故A正确;
B.用过量氨水吸收烟道气中的SO2,离子方程式:SO2+2NH3•H2O═SO32-+2NH4+,故B错误;
C.向NaHSO4溶液中加入Ba(OH)2至中性,二者物质的量之比2:1,离子方程式:2H++SO42-+Ba2++2OH-═2H2O+BaSO4↓,故C错误;
D.向AgCl饱和溶液中滴加Na2S溶液,离子方程式:2AgCl(s)+S2-(aq)═Ag2S(s)+2Cl-(aq),故D错误;
故选:A.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意反应物用量对反应的影响,选项BC为易错选项.


科目:高中化学 来源: 题型:选择题
| A. | 可溶性铁盐、铝盐均可用于水的净化 | |
| B. | “开发利用新能源”、“汽车尾气催化净化”都能提高空气质量 | |
| C. | 电解NaCl溶液可制得金属钠 | |
| D. | 在海轮外壳上镶嵌上锌块,可减缓船体的腐蚀速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
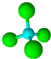
 近年来,科学家合成了一种稳定的氢铝化合物Al2H6.Al2H6的球棍模型如图所示,它的熔点为150℃,可用作高能燃料或储氢材料.下列说法正确的是( )
近年来,科学家合成了一种稳定的氢铝化合物Al2H6.Al2H6的球棍模型如图所示,它的熔点为150℃,可用作高能燃料或储氢材料.下列说法正确的是( )| A. | 1molAl2H6中约含有4.8×1024个σ键 | |
| B. | 60gAl2H6中含铝原子约为1.2×1023个 | |
| C. | Al2H6可以燃烧,产物为氧化铝和水 | |
| D. | Al2H6在固态时所形成的晶体是离子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 H++H2PO4-、H2PO4-
H++H2PO4-、H2PO4-  H++HPO42-、HPO42-
H++HPO42-、HPO42-  H++PO43-
H++PO43-查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在溶剂中提高苯的比例,能提高溶液的导电性 | |
| B. | 电解时阳极的电极反应式为2Br--2e-=Br2 | |
| C. | 电解时可用铁作阳极材料 | |
| D. | 汽油样品应加在阴极区 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
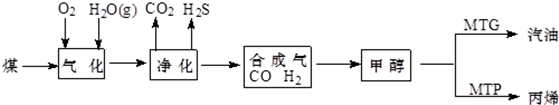
 .
.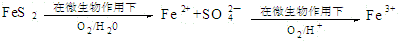
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
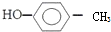
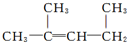 的名称:1,3-二甲基-2丁烯( )
的名称:1,3-二甲基-2丁烯( )| A. | ⑤ | B. | ④⑤ | C. | ③⑦ | D. | ②⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L CCl4含有的分子数为NA | |
| B. | 常温常压下,17g NH3所含的原子数目为4NA | |
| C. | 铝与足量盐酸反应,生成2.24L H2时,转移的电子数为0.2NA | |
| D. | 0.1mol/L Na2CO3溶液中含有的Na+数目为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com