
(1)已知常温时32g甲烷燃烧放出的热量为akg,写出甲烷标准燃烧热的热化学方程式 ;
(2)以甲烷为燃料和KOH溶液为电解质制成燃料电池。
其电池负极反应式是: ;
其电池总反应化学方程式是: 。
(1)CH4(g)+2O2(g)=CO2(g)|2H2O(l) △H=-0.5akJ/mol。
(2)CH4-8e-+10OH-=CO32-+7H2O、H4+2O2+2NaOH=Na2CO3+3H2O。
解析:(1)考查热化学方程式的书写。燃烧热是1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以甲烷标准燃烧热的热化学方程式CH4(g)+2O2(g)=CO2(g)|2H2O(l) △H=-0.5akJ/mol。
(2)考查电极反应式的书写。在原电池中负极失去电子,发生氧化反应,所以负极的电极反应式为CH4-8e-+10OH-=CO32-+7H2O,总反应式为CH4+2O2+2NaOH=Na2CO3+3H2O。


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案科目:高中化学 来源: 题型:
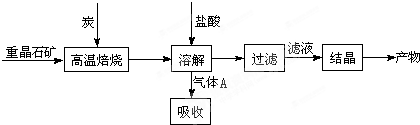
| 高温 |
| 高温 |
| c(Br-) |
| c(Cr-) |
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.浓度/mol?L-1 时间/min |
NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
查看答案和解析>>
科目:高中化学 来源:山西省太原五中2011-2012学年高二上学期期末检测化学理科试题 题型:058
某铬盐厂生产过程中排出含Cr2O72-的工业酸性废水.为防止污染环境,现采用下列工艺流程进行处理后再排出.

在整个处理过程中,Cr2O72-被还原为Cr3+,溶液的pH值逐渐升高,最后滤出的沉淀有Cr(OH)3和Fe(OH)3,试分析这个污水处理过程,回答:
(1)电解时,铁电极上的电极反应式:
阳极:________,
阴极:________;
(2)用铁(而不用炭)作电极进行电解的原因:________;
(3)Cr2O72-在酸性环境中被还原剂还原,能除去Cr2O72-.减少溶液酸性是整个工艺流程中关键的一步,这个变化的离子方程式是________;
(4)电解过程中当H+浓度小到一定程度时,便会析出Cr(OH)3、Fe(OH)3沉淀,已知常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5 mol/L,溶液的pH应至少为________.
查看答案和解析>>
科目:高中化学 来源:期末题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com