
| A. | 银氨溶液 | B. | 金属钠 | ||
| C. | FeCl3溶液 | D. | 新制的Cu(OH)2碱性悬浊液 |
分析 四种物质都溶于水,乙酸和甲酸具有酸性,葡萄糖和甲酸含有醛基,可与新制氢氧化铜悬浊液在加热条件下发生氧化还原反应,以此鉴别.
解答 解:A.银氨溶液不能鉴别葡萄糖和甲酸,故A错误;
B.四种溶液都含有水,都可与钠反应生成氢气,不能鉴别,故B错误;
C.氯化铁都四种物质都不反应,不能鉴别,故C错误;
D.乙醇与新制氢氧化铜悬浊液不反应,乙酸与新制氢氧化铜悬浊液发生中和反应,沉淀溶解,葡萄糖与新制氢氧化铜悬浊液在加热条件下发生氧化还原反应生成砖红色沉淀,甲酸与新制氢氧化铜悬浊液发生中和反应,沉淀溶解,在加热条件下发生氧化还原反应生成砖红色沉淀,可鉴别,故D正确.
故选D.
点评 本题考查物质的检验和鉴别,为高考常见题型和高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同,注重基础知识的学习,难度不大.


 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:选择题
| 电极反应式 | 出现环境 | |
| A | O2+2H2O+4e-═4OH- | 碱性环境下氢氧燃料电池的负极反应 |
| B | 4OH--4e-═2H2O+O2↑ | 弱酸性环境下钢铁的吸氧腐蚀 |
| C | 2H++2e-═H2↑ | 用惰性电极电解NaOH溶液的阴极反应 |
| D | H2-2e-═2H+ | 用惰性电极电解H2SO4的阳极反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | M层上有2对成对电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
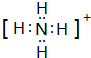 (用元素符号表示).
(用元素符号表示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液态氟化氢中存在氢键,所以其分子比氯化氢更稳定 | |
| B. | 由碳、氮原子形成的化合物比金刚石硬,其主要原因是碳氮键比碳碳键更短 | |
| C. | S8和NO2都是共价化合物,NH4Cl和CaC2都是离子化合物 | |
| D. | 若ⅡA某元素的原子序数为m,则同周期ⅢA元素的原子序数有可能为m+10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝与稀盐酸的反应 | |
| B. | 灼热的木炭与CO2反应 | |
| C. | 甲烷在氧气中的燃烧反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x-3 | B. | x+3 | C. | x+11 | D. | x-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ⑤⑥⑦ | C. | ①②⑦ | D. | ③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com