
分子式为C5H12O的醇与和它相对分子质量相等的一元羧酸进行酯化反应,生成的酯共有(不考虑立体异构) ( )
A.15种 B.16种 C.17种 D.18种
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源:2016届浙江省嘉兴、杭州、宁波五校高三上第一次联考化学试卷(解析版) 题型:填空题
K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾晶体)为翠绿色晶体,溶于水,难溶于乙醇,110℃下失去结晶水,230℃分解;是制备负载型活性铁催化剂的主要原料。
实验室利用(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵)、H2C2O4(草酸)、K2C2O4(草酸钾)、30%双氧水等为原料制备三草酸合铁酸钾晶体的部分实验过程如下:

已知:沉淀: FeC2O4·2H2O既难溶于水又难溶于强酸
6FeC2O4+3H2O2+6K2C2O4 4K3[Fe(C2O4)3]+2Fe(OH)3↓
4K3[Fe(C2O4)3]+2Fe(OH)3↓
2Fe(OH)3+3H2C2O4+3K2C2O4 2K3[Fe(C2O4)3]+6H2O
2K3[Fe(C2O4)3]+6H2O
(1)检验硫酸亚铁铵是否变质的试剂是 ;溶解时加几滴稀硫酸的目的是 。
(2)沉淀过滤后,洗涤1的操作方法是 。
(3)在沉淀中加入饱和K2C2O4溶液,并用40 ℃ 左右水浴加热,再向其中慢慢滴加足量的30%H2O2溶液,不断搅拌。此过程需保持温度在40 ℃ 左右,可能的原因是 。加入30%过氧化氢溶液完全反应后,煮沸的目的是 。
(4)洗涤2中所用洗涤试剂最合适的是 (填选项字母)。
A.草酸钠溶液 B.蒸馏水 C.乙醇 D.KCl溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东广州执信中学高二上期中文化学试卷(解析版) 题型:?????
下列营养物质在人体内发生的变化及其对人的生命活动所起的作用叙述不 正确的是( )
正确的是( )
A.淀粉 葡萄糖
葡萄糖 CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
B.维生素 葡萄糖
葡萄糖 CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
C.油脂 甘油和高级脂肪酸
甘油和高级脂肪酸 CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
D.蛋白质 氨基酸
氨基酸 人体所需的蛋白质(人体生长发育)
人体所需的蛋白质(人体生长发育)
查看答案和解析>>
科目:高中化学 来源:2016届浙江临海台州中学高三上学期第三次统练化学试卷(解析版) 题型:选择题
常见的无机酸25℃时在水溶液中的电离平衡常数如下表,下列选项正确的是
氢氰酸(HCN) | 碳酸(H2CO3) | 氢氟酸(HF) |
K = 6.2×10-10 | Ka1= 4.2×10-7 | K=6.61×10-4 |
A.氟化钠溶液中通入CO2:2F-+H2O+CO2=2HF+CO32-
B.NaCN与HCN的混合溶液中:2c(Na+) = c(CN-)+ c(HCN)
C.0.2 mol•L-1 HCN溶液与0.1 mol•L-1NaOH溶液等体积混合后,溶液的pH>7
D.25℃时同浓度的NaCN和NaF溶液的pH值前者小于后者
查看答案和解析>>
科目:高中化学 来源:2016届四川成都第七中学高三阶段测试三理综化学试卷(解析版) 题型:填空题
甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,二氧化碳加氢合成甲醇是合理利用二氧化碳的有效途径。由二氧化碳制备甲醇过程中可能涉及反应如下:
反应Ⅰ:CO2(g)+3H2(g) 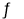 CH3OH(g)+H2O(g) △H1=-49.58KJ/mol
CH3OH(g)+H2O(g) △H1=-49.58KJ/mol
反应Ⅱ:CO2(g)+H2(g) 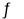 CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g) 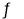 CH3OH(g) △H3=-90.77KJ/mol
CH3OH(g) △H3=-90.77KJ/mol
回答下列问题:
(1)反应Ⅱ的△H2= ,反应Ⅰ自发进行条件是 (填“较低温”、“较高温”或“任意温度”)。
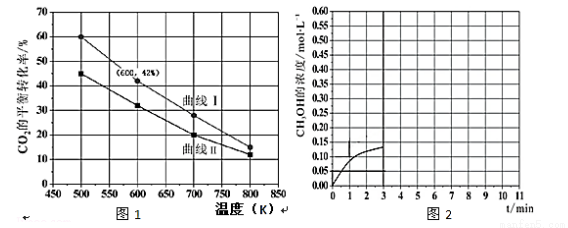
(2)在一定条件下3L恒容密闭容器中,充入一定量的氢气和二氧化碳仅反应反应Ⅰ,实验测得反应物在不同起始投入量下,
体系中二氧化碳的平衡转化率与温度的关系曲线,如图1所示。
① 氢气和二氧化碳的起始的投入量以A和B两种方式投入
A:n(H2)=3mol n(CO2)=1.5mol
B:n(H2)=3mol n(CO2)=2mol,曲线Ⅰ代表哪种投入方式 (用A、B表示)
②在温度为500K的条件下,按照A方式充入3摩尔氢气和1.5摩尔二氧化碳,该反应10分钟时达到平衡:A.此温度下的平衡常数为 ;500K时,若在此容器中开始充入0.3摩尔氢气和0.9摩尔二氧化碳、0.6摩尔甲醇、x摩尔水蒸气,若使反应在开始时正向进行,则x应满足的条件是 。
b.在此条件下,系统中甲醇的浓度随反应时间的变化趋势如图2所示,当反应时间达到3分钟时,迅速将体系温度升至600K,请在图2中画出3~10分钟内容器中甲醇的浓度变化趋势曲线。
(3)固体氧化物燃料电池是一种新型的燃料电池,它是以固体氧化锆氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过,该电池的工作原理如图3所示,其中多孔电极均不参与电极反应。图3是甲醇燃料电池的模型。
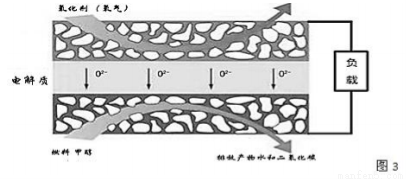
①写出该燃料电池的负极反应式 。
②如果用该电池作为电解装置,当有16g甲醇发生反应时,则理论上提供的电量最多为 摩尔。
查看答案和解析>>
科目:高中化学 来源:2016届山西平遥中学等重点中学高三第三次练兵化学试卷(解析版) 题型:选择题
用NA表示阿伏伽德罗常数的值,下列叙述正确的是
A.常温常压下,92g的二氧化氮和四氧化二氮的混合气体中含有原子数为6NA
B.惰性电极电解食盐水,若电路中通过NA个电子,则阳极产生气体11.2L
C.0.25mol过氧化钠中含有的阴离子数为0.5NA
D.在KIO3+6HI=KI+3I2+3H2O反应中,每生成3mol碘转移的电子数为6NA
查看答案和解析>>
科目:高中化学 来源:2016届宁夏回族自治区银川一中高三上第五次月考理化学试卷(解析版) 题型:填空题
300℃下,将2 mol SO2 1 mol O2混合于2 L的恒容密闭容器中,发生反应:2SO2(g)+O2(g) 2SO3(g) ΔH,2分钟末达到平衡,测得SO2的转化率为60%。请根据化学反应的有关原理回答下列问题:
2SO3(g) ΔH,2分钟末达到平衡,测得SO2的转化率为60%。请根据化学反应的有关原理回答下列问题:
(1)能证明反应已经达到平 衡状态的是
衡状态的是
①c(SO2):c(O2):c(SO3)=2:1:2
②单位时间内生成nmol SO3的同时消耗nmol SO2
③反应速率2v(SO3)= v(O2)
④温度和体积一定时,容器内压强不再变化
⑤温度和压强一定时,混合气体的密度不再变化
(2)如图表示该反应的速率(v)随时间(t)的变化的关系:
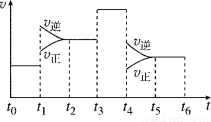
据图分析:你认为t3时改变的外界条件可能是________;t6时保持体积不变向体系中充入少量He气,平衡 移动。(填“向左”“向右”或“不”)。SO2%含量最高的区间是
(t0~t1,t2~t3,t3~t4,t5~t6)。
(3) 300℃时,该反应的平衡常数为 ,若升高温度该反应的平衡常数减小,则ΔH 0(填“大于”小于“或“不确定”)
(4)如果在相同条件下,上述反应从逆反应方向进行,开始时加入SO20.6 mol加入SO31.4 mol,若使平衡时各物质的量浓度与原来平衡相同,则还应加入O2 mol。
查看答案和解析>>
科目:高中化学 来源:2016届河北正定中学高三上学期第五次月考理科综合化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值,下列叙述中不正确的是
A.1 mol Cl2与足量NaOH反应,转移的电子数为NA
B.常温常压下,11.2 L甲烷中含有的氢原子数小于2 NA
C.1 mol碳烯(∶CH2)所含的电子数目为6 NA
D.T ℃时,1 L pH=6的纯水中含OH-数为10-6 NA
查看答案和解析>>
科目:高中化学 来源:2015-2016北京大学附中宇华教育集团高二12月化学卷(解析版) 题型:选择题
下列实验操作或对实验事实的叙述中存在错误的是 ( )
A.用50mL酸式滴定管准确量取23.20mL酸性KMnO4溶液,放入锥形瓶中待用
B.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法
C.酸碱中和滴定时,锥形瓶未用待装液润洗。
D.用惰性电极电解NaCl溶液,一段时间后,再加盐酸,可使溶液与原溶液完全一样。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com