
| A、N2O4和NO2的分子数比为1:2 |
| B、N2O4和NO2的浓度相等 |
| C、平衡体系的颜色一定不再改变 |
| D、单位时间有1 mol N2O4变为NO2的同时,有2 mol NO2变为N2O4 |


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
| A、CH3OCH2CH3 |
| B、CH3CH(OH)CH3 |
| C、CH3COCH3 |
| D、CH3COOCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用干燥pH试纸测定某新制氯水的pH |
| B、用酒精萃取碘水中的碘 |
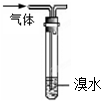
| C、用如图装置能除去乙烷中混有的乙烯 |
| D、用25mL碱式滴定管量取20.00mL KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、①③④ | D、③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在蔗糖溶液中加入几滴稀硫酸,水浴加热5min,加入NaOH溶液至碱性,再加入银氨溶液并水浴加热检验葡萄糖的生成 |
| B、苯中混有苯酚可与足量氢氧化钠溶液反应后分液除去 |
| C、使C2H5Br和NaOH溶液混合后水解,取上层清液,滴加AgNO3溶液检验溴元素 |
| D、只用溴水一种试剂即可鉴别甲苯、己烯、乙醇、四氯化碳四种液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100mL 1mol/L MgCl2溶液 |
| B、200mL 0.25mol/L AlCl3溶液 |
| C、100ml 1mol/L NaCl溶液 |
| D、200ml 0.5mol/L HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 3 |
| 2 |
| T/K | 303 | 313 | 323:] |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| PH | 8.1 | 8.4 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com