
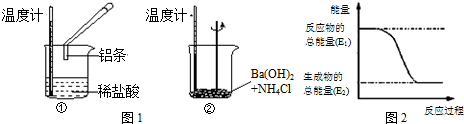
分析 (1)化学反应中,温度升高,则反应放热;温度降低则反应吸热;图2中反应物总能量大于生成物总能量,该反应为放热反应,据此进行解答;
(2)①自发进行的放热的氧化还原反应能设计成原电池;
②该原电池中,失电子的金属单质作负极,不如Cu活泼的金属或导电的非金属性作正极,电解质溶液为可溶性的氯化铁溶液,负极上Cu失电子发生氧化反应、正极上铜离子得电子发生还原反应.
解答 解:(1)Al与HCl反应后,温度升高,则说明反应放热,离子反应方程式为:2Al+6H+═2Al3++3H2↑;Ba(OH)2•8H2O与NH4Cl的反应温度降低,说明反应为吸热反应,化学反应方程式为:Ba(OH)2•8H2O+2NH4Cl=BaCl2+10H2O+2NH3;反应①为放热反应,反应物的总能量大于生成物的总能量,所以①的能量变化可用图2表示;故答案为:放;2Al+6H+═2Al3++3H2↑;吸;Ba(OH)2•8H2O+2NH4Cl=BaCl2+10H2O+2NH3;①;
(2)①自发进行的放热的氧化还原反应能设计成原电池,A反应中没有电子转移,不属于氧化还原反应,所以不能设计成原电池;B属于自发进行的放热的氧化还原反应,所以能设计成原电池,故答案为:B;
②该原电池中,Cu失电子作负极,不如Cu活泼的金属或导电的非金属性作正极,电解质溶液为可溶性的氯化铁溶液,正极上铜离子得电子发生还原反应,电极反应式为:2Fe3++2e-=2Fe2+,负极上Cu失电子发生氧化反应,电极反应式为:Cu-2e-═Cu2+;故答案为:2Fe3++2e-=2Fe2+.
点评 本题考查学生根据实验现象判断放热与吸热反应,原电池设计,难度不大,侧重于基础知识的考查,注意把握实验原理.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | D元素处于元素周期表中第三周期ⅣA族 | |
| B. | 四种元素的原子半径:A<B<D<C | |
| C. | B、D的氧化物均为酸性氧化物 | |
| D. | 一定条件下,B单质能置换出D单质,C单质能置换出A单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
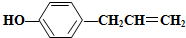 ,下列叙述不正确的是( )
,下列叙述不正确的是( )| A. | 1 mol胡椒粉最多可与4 mol氢气发生反应 | |
| B. | 1 mol胡椒粉最多可与3 mol溴水发生反应 | |
| C. | 胡椒粉可与氯化铁溶液反应,使溶液呈紫色 | |
| D. | 胡椒粉与NaHCO3溶液反应产生CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期X、Y、Z元素的最高价含氧酸的酸性:HXO4>H2YO4>H3ZO4,则气态氢化物还原性HX<H2Y<ZH3 | |
| B. | 元素R的含氧酸的化学式是H2RO3,则其气态氢化物的化学式就是RH4 | |
| C. | 金属与非金属元素分界线附近的元素是过渡元素 | |
| D. | 物质的量相同的Na+、O2-、NH3三种微粒,一定含有相同的质子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定是x+2 | B. | 肯定是x+2或x+8或x+32 | ||
| C. | 肯定是x+2或x+12或x+26 | D. | 肯定是x+2或x+10或x+26 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1盐酸的澄清透明溶液:Fe3+、Na+、SO42-、Br- | |
| B. | pH=1的溶液中:Na+、K+、MnO4-、HCO3- | |
| C. | 能使石蕊变红的溶液:Cu2+、Na+、AlO2-、Cl- | |
| D. | c(H+)=1×10-13mol/L的溶液中:Mg2+、Cu2+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定前,未用NaOH溶液对锥形瓶进行润洗 | |
| B. | 滴定过程中,有少量盐酸滴在锥形瓶外 | |
| C. | 盛装盐酸前,未对酸式滴定管进行润洗 | |
| D. | 滴定终点时,对酸式滴定管俯视读数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com