
下列事实能说明氯的非金属性比硫强的是 ( )
A.铁与硫反应生成硫化亚铁,而铁与氯气反应时生成氯化铁
B.与金属钠反应,氯原子得一个电子,而硫原子能得两个电子
C.常温时氯气呈气态,而硫呈现固态
D.氯的最高价为+7价,而硫的最高价为+6价
科目:高中化学 来源: 题型:
聚酰胺66常用于生产帐篷、渔网、降落伞及弹力丝袜等织物,可利用下列路线合成:



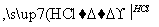
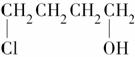
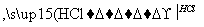 D
D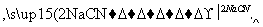
A B C
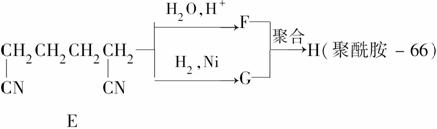
已知反应:R—CN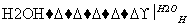 R—COOH
R—COOH
R—CN R—CH2NH2
R—CH2NH2
(1)能与银氨溶液反应的B的同分异构体的结构简式为________。
(2)D的结构简式为_______________________________________;
①的反应类型为________。
(3) 为检验D中的官能团,所用试剂包括NaOH水溶液及________。
为检验D中的官能团,所用试剂包括NaOH水溶液及________。
(4)由F和G生成H的反应方程式为________________________________
___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在2012年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 molXY2含有54 mol电子。
(1)该融雪剂的化学式是 ;X与氢元素形成的化合物的电子式是 。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是 ;D与E能形成一种非极性分子,该分子的结构式为 ;D所在族元素的氢化物中,沸点最低的是 。
(3)元素W与Y同周期,其单质是原子晶体;元素Z的单质分子Z2中有3个共价健;W与Z能形成一种新型无机非金属材料,其化学式是 .
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z分别是三种单质,它们都是常见的金属或非金属.M、N、R是常见的三种氧化物.其中一种具有高熔点,而且有如下反应(条件未标出,方程未配平):
⑴X + Z → N;⑵M+X → N;⑶ M+Y→ R+X 。若X是非金属,则组成Y单质的元素在周期表中的位置是
A.第二周期ⅣA族 B.第二周期ⅥA族
C.第三周期ⅡA族 D.第三周期ⅣA族
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F为原子序数依次增大的主族元素。已知A、C、F三原子的最外层共有12个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均能生成盐和水,D元素原子的最外层电子数比次外层电子数少4,E元素原子次外层电子数比最外层电子数多3。回答:
(1)写出下列元素的符号:A________、D________、E________;
(2)用电子式写出B、F形成的化合物的电子式___________________;(3)A、C两种元素最高价氧化物的水化物反应的离子方程式为__________________________;(4)D的固态氧化物是_______晶体,含n molD的氧化物的晶体中含D—O共价键为_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 mol CH3COONa固体,溶液中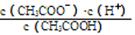 (填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式 。
(填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式 。
(2)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可以高达10.5,试用离子方程式解释土壤呈碱性的原因 。加入石膏(CaSO4·2H2O)可以使土壤碱性降低,有关反应的化学方程式为 。
(3)常温下向20 mL 0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下:
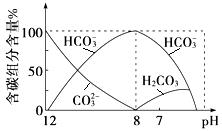
回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32- (填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒有 、 ,溶液中含量最多的三种微粒的物质的量浓度的大小关系为 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
仅用下表提供的玻璃仪器(非玻璃仪器任选)或实验装置就能实现相应实验目的的是( )
| 选项 | A | B | C | D |
| 实验 目的 | 除去KCl中少量MnO2 | 用10 mol·L-1盐酸配制100 mL 0.1 mol·L-1盐酸 | 用NaCl溶 液制备氯 化钠晶体 | 除去乙烯中少量SO2 |
| 实验仪器或装置 | 烧杯、玻璃 棒、分液漏斗 | 100 mL容量瓶、玻璃棒、烧杯 |
|
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com